1. 上海市浦东新区人民医院骨科,上海 201200
2. 第二军医大学附属长征医院脊柱外科,上海 200003
3. 上海市浦东新区人民医院病理科,上海 201200
【摘要】
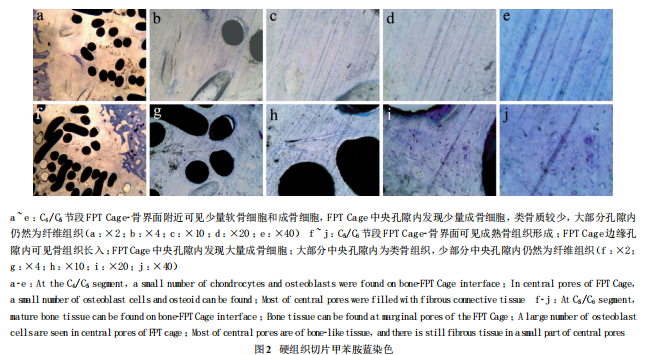
目的观察富血小板血浆(PRP)促进纤维多孔钛椎体间融合器(fiber porous titanium Cage,FPT Cage)的骨长入作用。方法 健康成年比格犬 6 只,体质量 12.5~ 15.0 kg,雌雄各 3 只。取比格犬前肢外周静脉血20.0 mL,采用二次离心法制备PRP,同时对外周静脉血及PRP 行血小板计数。行颈椎前路 C4/C5/C6椎间盘切除FPT Cage 椎间融合术,C4/C5 节段单纯使用 FPT Cage,C5/C6节段采用激活的 PRP 浸泡的 FPT Cage。术后 4 个月处死比格犬后行硬组织切片检查,观察 C4/C5/C6节段 FPT Cage 中骨长入的情况。结果 C4/C5 节段椎间隙FPT Cage- 骨界面附近可见少量软骨细胞和成骨细胞 ;FPT Cage 中央孔隙内发现少量成骨细胞,类骨质较少,大部分孔隙内仍然为纤维组织。C5/C6节段椎间隙 FPT Cage- 骨界面可见成熟骨组织形成 ;FPT Cage 边缘孔隙内可见骨组织长入 ;FPT Cage 中央孔隙内发现大量成骨细胞 ;大部分中央孔隙内为类骨组织,少部分中央孔隙内仍然为纤维组织。结论 在比格犬体内实验研究中,复合PRP 可以促进 FPT Cage 内的骨长入。
【关键词】 狗 ;内固定器 ;生物力学 ;动物,实验【中图分类号】R 318.01 【文献标识码】 A 【文章编号】 1672-2957(2016)02-0096-05【DOI】 doi :10.3969/j.issn.1672-2957.2016.02.008
颈椎融合术中普遍使用椎体间融合器(Cage)已有 20 余年历史,Cage 造成的置入物沉降、移位以及加速相邻节段退变等力学相关并发症倍受关注,人工椎间盘等非融合技术目前也只能作为椎体间融合术的一个补充[1-2]。现在临床使用的 Cage 材料主要是聚醚醚酮(PEEK)及碳纤维增强的聚合物(CFRP),但这 2 种材料自身无成骨能力,因而Cage 多设计为中空环状,内部仍然要填充植骨材料,且植骨材料与椎体终板接触面小,融合过程缓慢,融合率受限[1]。PEEK、CFRP 等材料弹性模量约为30.0 GPa,仍大大高于椎体皮质骨的弹性模量(18.0 GPa),使用 Cage的颈椎手术患者多为骨质疏松的中老年人,Cage 沉陷仍然是影响治疗效果的重要因素 ;进一步改进椎体间融合材料,改善其力学和生物学性能对于获得良好的融合效果至关重要[2]。2004 年 Zou 等[3]报道用多孔钽制作椎间融合器进行动物实验,其具有孔隙结构,可以提供骨长入的条件,同时适当的力学强度既起到支撑作用,又减少了应力遮挡,是作为椎体间融合的良好材料,尤其适用于老年骨质疏松患者。但对多孔新型材料进行组织切片发现,骨组织往往仅长入多孔材料表层孔隙或孔隙的外边缘,并不长满材料内部孔隙[3-4],因此在多孔材料中引入骨诱导因素,对实现骨长入、形成持久生物固定有重要意义[5]。富血小板血浆(PRP)主要来源于自体,取材方便,制备简便,价格低廉,作为骨诱导因素的临床应用前景广阔[6]。本研究旨在观察 PRP 能否加速甚至促进纤维多孔钛椎体间融合器(fiber poroustitanium Cage,FPT Cage)的骨长入过程。
1 材料和方法
1.1 实验动物、试剂及仪器
选取 6 只健康实验用比格犬(上海中医药大学动物实验中心提供),雌雄各 3 只,年龄 7 ~ 9 岁,体质量 12.5~ 15.0 kg,平均 13.8 kg。经上海中医药大学动物实验伦理委员会审查,实验过程中对动物的处置符合相关动物伦理学标准[7]。4.0%枸橼酸钠抗凝剂(四川南格尔生物科技有限公司,中国);无水 CaCl(西陇化工,中国) 2 ;凝血酶冻干粉(上海第一生化药业有限公司,中国);10.0%多聚甲醛溶液(苏州市第二化工研究所有限责任公司,中国)。体积分数100%纯丙酮溶液(上海凌峰化学试剂有限公司,中国)。甲基丙烯酸甲酯有机玻璃(上海华东理工大学配制)。电子天平(赛多利斯,德国);TDL-80-2B 低速台式离心机(上海安亭科学仪器厂,中国);-80℃低温冰箱(三洋,日本);XE2100 全自动血细胞分析仪(希森美康,日本);EXAKT 510脱水仪、EXAKT 520光固化包埋机、EXAKT 300 CP 切片机、EXAKT 400 CS 磨片机(艾卡特,德国);ZEISS Imager M1光学显微镜(蔡司,德国)。10.0%多聚甲醛溶液用0.1 mol/L 的磷酸盐缓冲溶液(pH 7.4,自配)稀释并调节为 pH 7.4 的 4.0% 的多聚甲醛溶液。凝血酶冻干粉和无水 CaCl 2电子天平称重后,用 0.9% 生理盐水配置为含 1 000 U/mL 的凝血酶及 100 g/L 的 CaCl 2凝血酶混合液,于 -20℃保存备用。
1.2 FPT Cage
实验用 FPT Cage 由本课题组自发研制,截面直 径 5.0 mm,高 度 1.0 cm。样 品 FPT Cage 孔 隙 率58.0%~95.0%,孔径 100.0~400.0 μm。样品 FPT Cage抗压强度190.7 MPa,抗弯强度159.0 MPa,弹性模量 4.15 GPa。样品 FPT Cage 孔隙度较天然珊瑚制成的人工骨明显提高,弹性模量介于人体皮质骨(12 ~18 GPa)与松质骨(0.1~2 GPa)之间(图 1)[8]。

1.3 PRP制备及血小板计数
动物手术前 20 min,取出 CaCl 2凝血酶混合液常温解冻,并采用 Landesberg 等[9]的方法制备PRP。用含有 1.0 mL 4.0% 复方枸橼酸钠的注射器取前肢静脉血 20.0 mL 摇匀,其中 1.0 mL 用于外周静脉血血小板计数,剩余 19.0 mL置入离心管中,转速 1 500 r/min、离心半径 12.98 mm 条件下离心 10 min,吸取全部上清及交界面以下3.0 mL 的红细胞至另一离心管,平衡后转速 3 000 r/min、离心半径 12.98 mm 条件下离心15 min,弃上清液上 3/4 部分,剩余液体 2.5~3.0 mL摇匀,即为 PRP。采用 XE2100 全自动血细胞分析仪测定外周静脉血及 PRP 中的血小板数量。
1.4 PRP与FPT Cage 的复合
动物手术使用FPT Cage 前 20 min,PRP 与 CaCl 2凝血酶混合液按体积比 9∶1(V/V)混合摇匀,共制备 2.8~ 3.3 mL,大约 15 min肉眼可见凝胶样物质。PRP 激活后将FPT Cage 置入直径4.0 mm的橡皮软管中,用 5.0 mL 注射器抽取激活的 PRP 灌注橡皮管中浸泡的FPT Cage,反复抽吸灌注 1 min,确保FPTCage 孔隙内充满激活中的 PRP。
1.5 手术方法及标本获取
3.0% 戊巴比妥钠 1 mL/kg 静脉麻醉,术前 30 min静脉滴注头孢拉定预防性抗感染,备皮并消毒铺巾,颈前右侧纵行切口切断颈长肌充分显露 C4/C5/C6椎间隙,适度牵开椎间隙清除椎间盘,牵引下 C4/C5节段放置无 PRP 浸泡的FPT Cage,C5/C6节段放置PRP 浸泡的 FPT Cage。麻醉苏醒后观察比格犬四肢肌力变化及呼吸情况,口服头孢拉定胶囊粉末预防感染。术后 4 个月静脉麻醉下快速出血致死,经左心室先后以 0.9%的生理盐水和4.0%多聚甲醛(pH7.4)灌流固定,完整切取 C4/C5/C6节段。
1.6 硬组织切片制备
将新鲜颈椎标本置于4.0%多聚甲醛固定液中固定 48 h 后流水冲洗 24 h,在 EXAKT 510 脱水仪中用 100%丙酮溶液脱水。脱水后将组织块置入塑料模具,在 EXAKT 520 光固化包埋机中做有机玻璃包埋。采用 Technovit 4 000黏合剂将有机玻璃包埋标本黏于载玻片 A 上,真空吸附于EXAKT 300 CP 切片机夹具,激光定位,金刚锯条暴露标本,EXAKT400 CS 磨片机对载玻片 A 上的标本表面抛光,在EXAKT 401 载片黏合装置上用Technovit 7210 VLC胶水将载玻片 B 黏附于标本的抛光面,从载玻片 B侧切割厚度约300.0 μm 的切片,黏附切片的载玻片B 在 EXAKT 400 CS 上磨片,最后用细砂纸对切片表面进行抛光。整个过程通过AW100 测量控制系统进行控制。实验的切片最终厚度为 5.0~10.0 μm。
1.7 甲苯胺蓝染色
将体积分数为1.0%的甲苯胺蓝染液直接滴加于颈椎硬组织切片表面 20 min,BASO 病理封固胶封固。在光学显微镜下观察,骨细胞呈蓝色,类骨质呈淡蓝色,新矿化骨呈深蓝色,成熟骨为淡紫色。
2 结 果
2.1 血小板计数
外周静脉血中血小板计数为(154.33±51.76)×109/L。PRP中血小板计数为(727.66±194.42)×109/L,血小板含量为外周静脉血的 4.71 倍。
2.2 一般情况
所有实验动物手术顺利,手术时间 1.0~ 1.5 h,出血量 50.0~ 80.0 mL,术后无神经功能障碍、伤口感染等手术并发症,均存活至处死前。处死过程中肉眼观察 FPT Cage 周围无炎性组织,所有 FPT Cage均保持在原位。
2.3 硬组织切片检查结果
光镜下观察所有FPT Cage 周围未见炎性细胞及排斥反应表现。所有 FPT Cage 周围均发现薄层的纤维囊组织。C4/C5节段 FPT Cage- 骨界面附近可见少量软骨细胞和成骨细胞 ;FPT Cage 中央孔隙内发现少量成骨细胞,类骨质较少,大部分孔隙内仍然为纤维组织(图 2 a ~ e)。C5/C6节段 FPT Cage- 骨界面可见成熟骨组织形成 ;FPT Cage 边缘孔隙内可见骨组织长入 ;FPT Cage 中央孔隙内发现大量成骨细胞 ;大部分中央孔隙内为类骨组织,少部分中央孔隙内仍然为纤维组织(图 2 f ~j)。
3 讨 论
3.1 促进FPT Cage 骨长入的研究现状
在材料学和生物力学方面,多孔材料骨长入速度与椎间融合器的孔隙率、孔隙直径、置入即刻稳定性、与骨界面之间的活动度等因素相关。Vehof等[10]报道了 FPT 材料复合转移生长因子的骨长入结果,组织切片观察发现骨长入率 >50%,可能与FPT 的高孔隙率有关,该研究采用的 FPT 材料孔隙率高达86%,中央区FPT材料直径为2.0 mm。Li等[11]的研究表明增加 FPT 材料的孔隙率可以增加其渗透性,有利于骨传导。本研究采用 FPT 材料,孔隙直径为 100.0~ 400.0 μm,孔隙率为58.0%~ 95.0%,与相关报道的促进骨长入的最佳 FPT 孔隙直径150.0~600.0 μm,孔隙率 > 60% 一致。如同任何多孔材料,尽管 FPT 孔隙率可以 > 90%,有利于骨长入,但随着孔隙率提高其力学性能随之明显下降,弹性模量降低到只有松质骨水平,强度也降低至不足以支撑椎体间高度,其延展性、可塑性和可加工性亦有所下降。所以在提高孔隙率的条件下如何增强 FPT 材料的强度和韧性很值得研究。
除了在提高孔隙率的同时提高 FPT 材料的强度和韧性之外,需要寻找方法对 FPT Cage 进行生物活性激活,即复合生物活性成分或者固定生物分子以增强其骨诱导性能,从而达到加速骨长入甚至促进骨长入的作用。已有研究证实 FPT 支架能支持细胞的黏附、增殖与分化,可作为支架材料复合种子细胞修复缺损,具有一定骨诱导能力。Sagomonyants等[12]报道了多孔钽可以促进老年人成骨细胞的分化增值,可以作为老年患者骨缺损治疗的支架材料。Li 等[11]的研究认为 FPT 作为支架载体不会抑制生长因子促骨形成作用。部分研究通过对 FPT 孔壁内表面进行生物活性处理,在其表面复合一层类骨磷灰石层[5],使成骨细胞更容易在其上黏附、生长、分化,获得更加快速、有效地成骨。Vehof 等[14]报道了钙磷涂层的 FPT 材料复合大鼠骨髓细胞有更好的骨融合表现。Vehof 等[10]报道了钙磷涂层的 FPT 材料填充转移生长因子与无涂层的 FPT 材料相比,无明显促进骨融合作用,同样的结果也被Kamoda[15]证实。且利用生物活性处理的 FPT 材料一则会增加患者的经济负担 ;二则其机理是利用Ca 2+促进细胞黏附表达来增加骨细胞生长达到骨融合,而细胞活性与患者的年龄呈负相关[15]。因此在老年骨质疏松患者中应用钙磷涂层的 FPT 材料的临床效果并不确切。
3.2 PRP对FPT Cage 骨长入的促进作用
大量的临床前研究提示 PRP 有促进组织愈合的作用[9],本研究在应用 FPT Cage 行椎间融合时复合 PRP,观察 PRP 对 FPT Cage 骨长入的促进作用。PRP 是一种通过离心获得的含高浓度血小板的血浆,通过自体血液分离和提纯出血小板,通过脱颗粒作用,在骨形成区域释放出大量的促骨生长因子及骨诱导因子,以促进骨融合。促进骨融合作用与PRP 中血小板的浓度亦有关,过少则没有足够的生长因子释放,过多则可能有抑制作用。Marx[16]提出PRP 中的血小板浓度必须是全血血小板浓度 4 倍以上,否则无法达到促进组织再生的作用。本实验制作的 PRP 中血小板浓度为外周静脉血的4.71 倍,具备产生大量生长因子促进骨生长的作用。
根据应用形式,PRP 又可以分为未激活 PRP 和激活的 PRP,后者又包括了 PRP 凝胶和 PRP 释放物或提取物(又叫富含生长因子的PRP)。未激活的PRP 释放的生长因子量较少,通常需激活使用,目前最常用的体外激活方法是添加CaCl 2和凝血酶启动凝血过程,该过程可以产生大量的生长因子刺激骨诱导及有丝分裂来加强骨生长,被认为是诱导骨长入的主要因素[7]。当 PRP 在体外应用或将 PRP 做为止血剂或组织包埋的媒介时都必须体外激活,而体内有足够的内源性凝血酶原激酶,体内应用 PRP是否仍需要体外激活尚无定论。
3.3 PRP在促进脊柱融合方面的研究
PRP的临床作用报道褒贬不一。2003年Hee等[17]报道在经椎间孔腰椎椎体间融合术中 PRP 可以加速椎间融合,但并没有提高椎间融合率。Lowery 等[18]的临床研究发现 PRP 可以促进腰椎PEEK 自体植骨融合。而 Sys 等[19]在腰椎后路单节段椎间融合的手术中发现,添加 PRP 的自体植骨融合组与对照组相比并无促进骨融合的作用,但其随访初始时间为术后 3 个月,而 PRP 加速骨融合作用应发生在早期,术后 3 个月这个时间点随访偏晚。同样,Cinotti 等[20]在兔腰椎后外侧植骨融合实验模型中发现 PRP 并没有促进自体植骨融合。Kamoda 等[15]在 PRP 联合羟基磷灰石应用于大鼠腰椎椎间融合的报道中,提到了在椎间融合器置入前 10 min 进行 PRP 激活,影像学及组织学观察证实 PRP 组具有更高的椎间骨融合率。Kroese-Deutman 等[21]利用中空的 FPT 材料内部填充 PRP 凝胶和自体骨混合物来治疗兔桡骨骨缺损,结果提示是否复合 PRP 对骨长入情况无明显影响。本研究中,在颈椎前路椎间融合术中应用FPT Cage 的同时复合激活的PRP,自身对照的硬组织切片结果表明复合 PRP 的FPT Cage 有更好的骨长入结果。置入 4 个月后,复合激活的 PRP 的FPTCage-骨界面可见成熟骨组织形成,FPT Cage 边缘孔隙内可见骨组织长入,FPT Cage 中央孔隙内发现大量成骨细胞,大部分中央孔隙内为类骨组织,骨融合的结果明显优于未复合 PRP 的 FPT Cage。综上所述,
本研究结果提示 FPT 材料可以作为良好的骨诱导载体,复合激活的 PRP 可加速FPTCage 中的骨长入,在颈椎融合术中具有良好的应用前景。但本研究存在样本量小,观察时间点少等缺点。未对动物体内 PRP 中生长因子的浓度进行检测,促进骨融合的最佳生长因子浓度有待进一步论证。不同的生物物种对生长因子的反应可能不同,本研究采用比格犬颈椎作为研究对象,其生物力学特性与人类不同,缺乏垂直应力刺激骨生长。本实验中用单纯FPT Cage 融合 C4/C5节段,用复合激活PRP 的 FPT Cage 融合颈 C5/C6节段,融合节段不同可能对结果产生影响。本实验仅通过硬组织切片来观察判断骨长入情况,未用直观的影像学检查甚至生物力学测试来观察 PRP 是否持续促进骨融合。以上因素可能影响临床应用结果。
参考文献
[1] 葛志通, 李建初. 超声介入治疗在血管疾病中的应用 [ J] . 协和医学杂志, 2020, 11 (1):62 - 67.
[2]韩建超, 李中华, 王瑾晔 . 镍钛合金材料在腔静脉滤器中的应用 [J] . 中国医疗设备, 2016, 31 (4):75 - 80.
[3]张承圣, 谢锐, 文飞. 下肢动脉粥样硬化闭塞支架术后再狭窄研究进展 [ J] . 中国动脉硬化杂志,2018, 26 (5): 525 - 530.
[ 4 ]郭一洁, 陈宇翔, 司全金. 冠心病合并 2 型糖尿病患者冠状动脉支架置入术后支架内再狭窄的影响因素研究 [ J] . 实用心脑肺血管病杂志, 2016,24 (3): 15 - 18.
[5]李方超. 冠脉支架术后再狭窄危险因素的临床分析 [ D] . 长春: 吉林大学, 2014.
[6]杨耀博. 股浅动脉支架置入术后再狭窄的危险预测因子———平均血小板体积 [ D] . 沈阳: 中国医科大学, 2020.
[7]胡紫宜, 苟菊香, 周倩 . 慢性静脉疾病生活质量量表的比较分析 [J] . 现代临床护理, 2019, 18 (4):70 - 76.
[8]章杰, 张喜成. 血栓性髂静脉狭窄的诊疗现状与趋势 [J] . 中国普外基础与临床杂志, 2019, 26 (3):369 - 373.
[9]毛由军. 髂静脉狭窄支架植入后支架内再狭窄机制的动物实验研究 [ D] . 苏州: 苏州大学, 2018.
[10]尹玉霞, 王鲁宁, 郝树斌, 等 . 医用镍钛记忆合金在微创介入领域的应用 [ J] . 中国医疗设备,2019, 34 (6): 153 - 156.
[11]马嘉丽, 于振华, 朱明, 等. 镍钛合金血管支架性能研究综述 [ J] . 金属功能材料, 2015, 22 (2):56 - 59.
[12]王成健, 孟增东, 张玉勤, 等 . 镍钛形状记忆合金的生物相容性研究进展 [ J] . 生物骨科材料与临床研究, 2016, 13 (1):65 - 68, 72.[13] 刘礼华, 杨恒, 王利明, 等 . 镍钛形状记忆合金应用及产业化现状 [ J] . 新材料产业, 2002 (8):29 - 32.
[14] Jani JM, Leary M, Subic A, et al. A review of shape memory alloy research, applications and op⁃ portunities [ J] . Mater Design, 2014 , 56 ( 4 ) :1078 - 1113.
[15 ] Duerig T. Titanium in Medical and Dental Applica⁃ tions [ M ] . Sawston Cambridge: Woodhead Pub⁃lishing, 2018 : 555 - 570.
[16]崔跃, 张宝祥, 马连彩, 等 . 镍钛合金在医疗器械领域应用和表面改性研究进展 [ J] . 材料导报, 2017, 31 ( S2):197 - 200.
[17] Holman H, Kavarana MN, Rajab TK. Smart materials in cardiovascular implants: Shape memory alloys and shape memory polymers [ J ] . Artif Organs, 2021, 45 (5):454 - 463.
[ 18 ] Tsujimura T, lida O, Fujita M, et al. Two - year clinical outcomes post implantation of EpicTM self - expanding Nitinol stents for the aortoiliac occlusive dis⁃ ease in patients with peripheral arterial disease [ J] . J Atheroscler Thromb, 2018, 25 (4): 344 - 349.
[19] Tsutsumi M, Muramatsu T, lshimori H, et al. TCTAP A - 100 clinical outcome of drug - eluting stent implan⁃ tation for diabetic patients with femoropopliteal disease in comparison with bare metal stent [ J] . J Am CollCardiol, 2015, 65 (17): S53 - S54.Cardiol, 2015, 65 (17): S53 - S54.
[20]黄亚. 磷酸胆碱支架抑制猪冠状动脉支架内再狭窄的研究 [ D] . 北京: 中国人民解放军军医进修学院, 2010.
[21]马福秋. 镍钛合金表面银基复合镀层的制备与性能研究 [ D] . 哈尔滨: 哈尔滨工程大学, 2012. 薛雯. 复合编织血管支架物理力学性能研究 [D] . 上海: 东华大学, 2019.
[22]薛雯. 复合编织血管支架物理力学性能研究 [D] . 上海: 东华大学, 2019.
[23]陶单单. 高耐疲劳 NiTi 合金外周血管支架的结构设计研究 [ D] . 重庆: 重庆理工大学, 2020.
[24] Vantadori S, Carpinteri A, Di Cocco V. Fatigue analysis of a near - equiatomic pseudo - elastic NiTi SMA [J] . Theor Appl Fract Mec, 2018, 94 (1): 110 - 119.
[25] Song MG, Su YY, Li C, at el. Evaluation of the me⁃ chanical properties and clinical application of nickel – titanium shape memory alloy scaphoid arc nail [ J] .
Eng Life Sci, 2021, 22 (5): 294 - 302.
[26] 黄朝霞 . 镍钛合金心血管支架电解抛光工艺及生物兼容性研究 [D] . 淄博:山东理工大学, 2020.
[27] 白继岳, 徐永清, 何晓清, 等 . 镍钛形状记忆合金生物相容性及其表面改性研究进展 [ J] . 中国
修复重建外科杂志, 2018, 32 (8):1091 - 1095.
[ 28 ] Perinetti G, Contardo L, Ceschi M, et al. Surface corrosion and fracture resistance of two nickel - titani⁃ um - based archwires induced by fluoride, pH, and thermocycling. An in vitro comparative study [ J] . Eur J Orthodonti, 2012, 34 (1): 1 - 9.
[29] Schwartz RS, Edelman ER, Carter A. Drug - eluting stents in preclinical studies: recommended evaluation from a consensus group [ J] . Circulation, 2002, 106(14): 1867 - 1873.
[ 30 ] Carter AJ, Aggarwal M, Kopia GA, Long - term effects of polymer - based, slow - release, sirolimus - eluting stents in a porcine coronary model [J] . Cardi⁃
ovascular research, 2004, 63 (4): 617 - 624.
[31]李方超. 冠脉支架术后再狭窄危险因素的临床分析 [ D] . 长春:吉林大学, 2014.
[32]夏永辉, 任玲, 徐克, 等 . 镁合金血管支架置入后内膜增生特点 [ J] . 介入放射学杂志, 2014, 23 (2):132 - 135.
[33]胡忠洲. 可降解涂层紫杉醇洗脱支架在猪外周动脉模型中的研究 [ D] . 北京:清华大学, 2016. 牟亚汝. 阿托伐他汀对糖尿病下肢动脉硬化 PTA 术后再狭窄影响的实验研究 [ D] . 济南:山东大学 , 2017.
[34]许祥玉. MRSP 对大鼠颈动脉球囊损伤后内膜增生的作用与机制研究 [ D] . 武汉:华中科技大学 , 2019.
[35]许祥玉. MRSP 对大鼠颈动脉球囊损伤后内膜增生的作用与机制研究 [ D] . 武汉:华中科技大学 , 2019.
[36 ] Hanke H, Strohschneider T, Oberhoff M, et al. Time
course of smooth muscle cell proliferation in the intima and media of arteries following experimental angioplasty [J] . Circ Res, 1990, 67 (3): 651 - 659.
[37] Ammann KR, Decook KJ, Tran PL, et al. Collective cell migration of smooth muscle and endothelial cells:impact of injury versus non - injury stimuli [ J] . J Biol Eng, 2015 (9): 19.
[38 ]马春婴, 王贺, 罗明华, 等. 支架置入后再狭窄病生机制及其防治的中西医研究进展 [J] . 世界科学技术 - 中医药现代化, 2015, 17 (2): 311 - 318.
[39] 李巍, 黄岚. PCI 术后再狭窄的病理生理及其危险因素 [ J] . 中国动脉硬化杂志, 2013, 21 ( 4 ): 375 - 380.
[4 0]丁付燕, 吕志前, 邹榕江, 等 . 聚乳酸聚碳酸酯共聚物涂层紫杉醇洗脱支架预防小型猪血管支架内再狭窄的实验研究 [ J] . 中国心血管杂志,2011, 16 (1): 39 - 43.
[41 ]徐锐. 重塑在血管成形术后再狭窄过程中作用和机制的实验 研 究 [ D ] . 天 津: 天 津 医 科 大学 , 2005.
[42 ]布伦. 罗格列酮对血管再狭窄影响的动物实验和临床研究 [ D] . 西安: 中国人民解放军第四军医大学, 2007.
[43] Murakami A. Towards the application of endovascular treatment for superficial femoral artery [ J] . Circ J, 2018, 82 (5): 1253 - 1254.
[44 ]李艳艳. 镍钛形状记忆合金及其在小动物临床上的应用前景 [ J] . 中国兽医杂志, 2016, 52 (9):63 - 65.
[45] Reddy D. Shape Memory Alloys [ J] . IJERA, 2016, 6 (7): 56 - 58.
[46 ]陈乙菲. 基于 CaN / NFAT 信号途径探讨血府逐瘀汤治疗血管损伤后内皮增生的作用机制研究 [ D] . 长春: 长春中医药大学, 2020.
[47] 郭明珂. 预防移植静脉内膜增生和再狭窄的实验研究 [ D] . 石家庄: 河北医科大学, 2010.
(所载文/图等内容均以为公众传播有益的参考信息为目的,并不意味着赞同作者观点,亦不对文中内容的科学性等作任何形式的保证。文章来源于网络,如有侵权请与我们联系删除。)
技术服务咨询 步经理 18910422384
 官方微信
官方微信艾佧科技(北京)有限公司 地址:北京市经济技术开发区地盛南街1号1幢3041室
2020@ 艾佧科技(北京)有限公司 京ICP备10236589号