【 摘要】
目的 比较3D打印和计算机辅助设计与制造(CAD/CAM)氧化锆种植体与纯钛种植体在动物体内的骨结合和成骨效果的差异,评价氧化锆种植体骨结合性能。
【 方法 】
分别将3D打印氧化锆、CAD/CAM 种植体和钛种植体各20枚随机植入6只Beagle犬的胫骨内,8周后观察氧化锆种植体的成功率和骨结合能力,并与钛种植体进行比较,观察指标为种植体的成功率、反向扭矩值、骨接触率和种植体周围骨密度。数据采用单因素方差分析( ANOVA) 进行比较。
【结果】
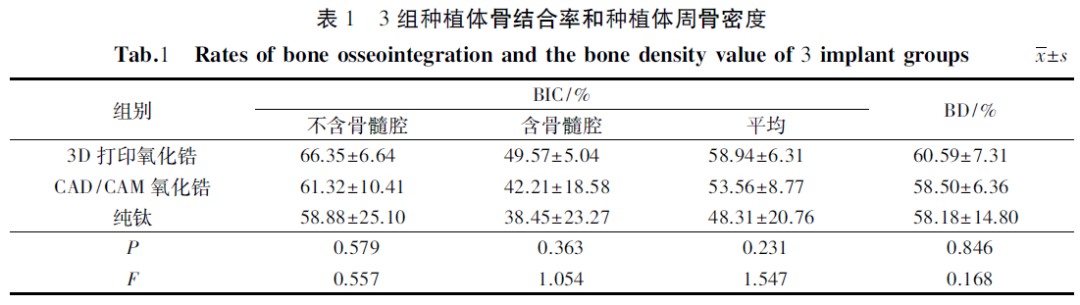
3组种植体的成功率均为100%。CAD/CAM氧化锆种植体组的反向转矩值均大于35N•m;3D 打印氧化锆种植体组的反向转矩值均大于35N•m; 钛种植体组中2颗种植体的反向转矩值为20~35N•m,8颗种植体的反向转矩值大于35N•m。组织学观察:3D打印氧化锆种植体、CAD/CAM氧化锆种植体和纯钛种植体的不含骨髓腔骨结合率分别为(66.35±6.64)%、(61.32±10.41)%和(58.88±25.10)%,含骨髓腔骨结合率分别为(49.57±5.04)%、(42.21±18.58)%和(38.45±23.27)%,平均骨结合率分别为(58.94±6.31)%、(53.56±8.77)%和(48.31±20.76)%,种植体周围骨密度分别为(60.59±7.31) %、(58.50±6.36)%和(58.18±14.80)%,差异无显著性(P>0.05) 。
【结论】
氧化锆种植体与纯钛种植体的骨结合能力相当,能形成紧密的直接骨接触,因此氧化锆种植体有望成为口腔种植体的可选材料。
【关键词】
骨结合;氧化锆种植体;不脱钙种植体骨切片。
钛种植体虽然因良好的“骨结合”[1]性能被广泛应用[2-3],但也会因金属过敏或美学问题而被限制应用[4]。随着数字化技术与修复技术紧密结合,氧化锆种植修复有了技术突破[5-6]。本研究已建立氧化锆种植体的三维模型[7],并制造3D打印氧化锆种植体和计算机辅助设计与制造(computer aided design & computer assomated manufacture,CAD/CAM) 氧化锆种植体。
为了氧化锆种植体能够达到与BEGO钛种植体TiPurePlus 相当的表面粗糙度(粗糙度Ra= 1~2μm)[8-9],预先对其表面进行喷砂和加热酸蚀处理。采用硬组织切片技术和反向转矩实验,比较两组氧化锆种植体与某公司纯钛种植体的成功率、骨结合率、种植体周骨密度和反向转矩值,评价氧化锆种植体骨结合性能[10]。
01材料与方法
1.1 实验材料
1.1.1 主要仪器Exakt510 脱水仪、Exakt520 光固化包埋机、Exakt 300CP 切片机、Exakt 400CS 磨片机(EXAKT公司,德国),光学显微镜(Olympus公司,日本) 。
1.1.2 手术器械NSK种植机(NSK公司,日本),种植器械盒(Thommen Medical AG,瑞士) ,手术刀柄,刀片,持针器骨膜剥离器,血管钳,组织剪,1号丝线,巾钳,铺巾。
1.1.3 实验药物速眠新(圣达动物药品有限公司,中国),3%戊巴比妥钠(科丰化学试剂有限公司,中国) ,注射用青霉素钠(华北制药股份有限公司,中国) ,多聚甲醛溶液、亚甲基蓝、酸性品红、高锰酸钾、苦味酸、磷酸氢二钠(豪普斯生物技术有限公司,中国) 。
1.1.4 种植体根据实验目的分为3组。
·
实验组1: 经过表面处理的3D打印氧化锆种植体20枚(昆山博力迈三维打印科技有限公司) (图1A) ;
·
·
实验组2: 经过表面处理的CAD/CAM 氧化锆种植体20枚(杭州口腔医院)(图1B) ;
·
·
实验组3: 某知名公司提供纯钛超亲水种植体20枚(上海宇井贸易有限公司)。
·
所有种植体直径3.5mm,长度8mm,穿龈2mm,基台高度4mm。
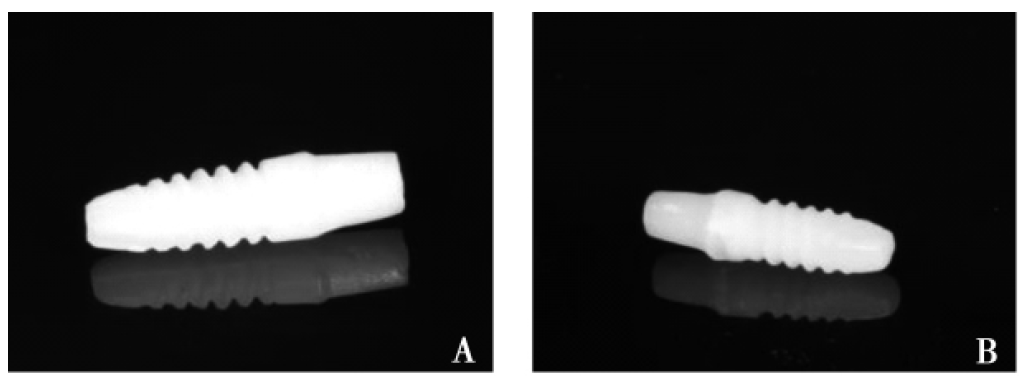
A: 3D 打印;B: CAD/CAM制作
图1 实验用一段式氧化锆植体
Fig.1 One-stage zirconia implant for experiment
1.2 实验方法
1.2.1 两组氧化锆种植体植入前表面处理3D打印氧化锆种植体和CAD/CAM氧化锆种植体植入前采用颗粒尺寸为250μm 的Al2O3粒子,喷砂力度0.8MPa,距离18mm,垂直喷砂4个循环,40%氢氟酸60℃酸蚀60min,蒸馏水超声震荡干燥后采用扫描电镜对3D打印氧化锆种植体和CAD/CAM氧化锆种植体表面形貌进行显微观察。
1.2.2 实验动物及模型制作实验动物成年雄性健康的Beagle犬共6只,15个月龄,质量为16~17kg。实验动物使用许可证号: SYXK(浙)2018-0012。使用动物质量合格证明编号: 201807863。动物种植体植入手术及饲养均在浙江中医药大学动物实验中心进行,所有实验动物在手术前均在笼子中隔离饲养1周。
将60枚植体编号1~60号,按随机分配的原则(随机数字表)植入6只Beagle犬的胫骨中,每只Beagle犬每侧胫骨植入5枚种植体。全麻前准备:术前禁食12h;术前0.5h肌注青霉素钠80万U以预防感染。种植手术:气管插管下,速眠新(0.04~0.08mg/kg) 对Beagle犬进行后腿肌肉注射。全麻起效后,常规消毒铺巾,后腿阿替卡因1.7mL浸润麻醉,切开、翻瓣、暴露胫骨外侧,逐级预备种植窝,植入种植体,安放愈合帽。对位缝合创口,种植术后即刻拍摄X线片,观察植入位置、角度(图2)。术后常规抗感染处理。
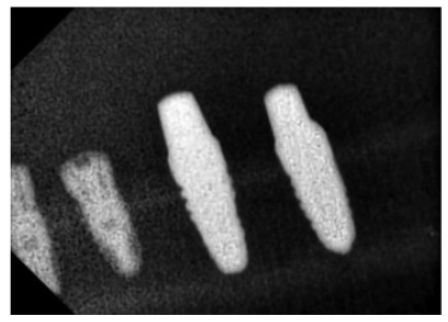
图2 种植术后即刻拍摄X 线片
Fig.2 X-rays taken immediately after implantation
1.2.3 标本处理在8周时,取3组种植体各10枚进行反向扭矩测试,将扭力扳手与种植体垂直相接,缓慢拧出种植体,扭力扳手刻度显示将种植体拧松的扭力值即为旋出扭力峰值。随后处死Beagle犬,将带有种植体的胫骨整段锯下(图3),生理盐水反复冲洗,固定后制备不脱钙硬组织切片。
图3 带有种植体的整段胫骨
Fig.3 Entire tibia with implants
1.2.4 不脱钙种植体骨切片的制备和染色用4%的甲醛固定浸泡,4℃冰箱保存72h,然后用70%乙醇溶液浸泡。修整带种植体的标本,标本大小约5mm×15mm×10mm,在Exakt510 脱水仪中使用70%~100%的乙醇溶液梯度脱水,在Exakt520光固化包埋机中进行树脂浸透包埋和聚合(图4)。完成聚合反应后,准备A、B 两张载玻片,用Technovit 4000粘接剂把标本包埋块粘合于载玻片A上,将载玻片A吸附于切片机夹具上,修整组织块,使用Exakt 400CS 磨片机对标本表面进行抛光,然后用Technovit-7210VLC胶水将载玻片B粘合于标本的抛光面侧,形成两侧载玻片、中间组织块的双夹结构。将载玻片A吸附在Exakt 300 CP a切片机夹具上,将切割厚度设定为150~200μm,切下载玻片B侧约150μm厚的切片,使用SiC和Al2O3砂纸自动磨片,设置厚度为30μm,再用细砂纸进行切片表面抛光,最终制作出厚度约为30μm的光滑种植体骨磨片。将切磨好的骨切片使用双蒸水进行超声清洗10min,自然干燥后用亚甲基蓝-酸性品红色,树脂封片。

图4 树脂浸透包埋块
Fig.4 Resin impregnated embedded block
1.2.5 图像分析/光学观察及骨接触率测定在光学显微镜下观察并采集图像,结合图像处理软件(Image-Pro Plus6.0)进行测量并根据骨接触率(bone-to-implant contact,BIC)和种植体周围骨密度(bone density,BD)公式计算,得到两组氧化锆种植体和某知名公司纯钛组种植体的不含骨髓腔骨结合率、含骨髓腔骨结合率、平均骨接触率和种植体周围骨密度。骨接触率(不含骨髓腔)=骨皮质、骨松质与种植体螺纹实际接触的长度之和/种植体螺纹植入骨皮质、骨松质的长度×100%;骨接触率(含骨髓腔)=骨髓腔与种植体螺纹实际接触的长度之和/种植体螺纹植入骨髓腔内的长度×100%;平均骨接触率=骨与种植体实际接触长度之和/种植体螺纹植入骨组织内的长度×100%;种植体周围骨密度(BD)=骨结合区域/整个结合区域×100%[11],测量方法为在螺纹端上放置一条切线,计算该切线与槽内种植体轮廓之间的像素。
1.3 统计学处理
采用SPSS17.0软件包对所有实验数据处理。进行统计学处理后的数据以(X的平均值±s)表示。数据采用单因素方差分析(ANOVA)进行比较,P<0.05表示差异有显著性。
02 结 果
2.1 两组氧化锆种植体表面处理后扫描电镜观察结果见图5~6,可见经喷砂+酸蚀后的氧化锆表面形成均匀的粗化效果。3D打印组表面大孔径12~17μm,小孔径1.1~2.6μm。经喷砂+酸蚀后的CAD/CAM组表面大孔径18~21μm,小孔径1.0~2.6μm。
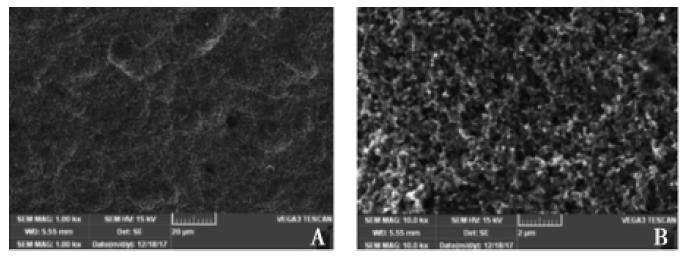
A:表面大孔径为12~17μm(×1000);B:小孔径为1.1~2.6μm(×10000)
图5 3D打印种植体(实验组1)表面电镜观察
Fig.5 Surface electron microscopy of 3D printed implants (Experimental group 1)

A:表面大孔径为18~21μm(×1000);B:小孔径为1.0~ 2.6μm(×10000)
图6 CAD/CAM 种植体( 实验组2) 表面电镜观察
Fig.6 Surface electron microscopy of CAD/CAM implants (Experimental group 2)
2.2 影像学观察结果
术后离体的Beagle犬胫骨经便携式X线机拍照,得到种植体植入的骨界面愈合情况(图7) 。种植体和周围骨组织嵌合紧密无间隙存在,螺纹均位于骨平面以下,光滑面均位于胫骨骨皮质外,植体植入方向与骨面垂直,植体之间的间距在2~3 mm,植体周围未见异常透射影像。三组种植体的成功率均为100%。

图7 种植体植入的骨界面愈合情况
Fig.7 Healing of bone interface after implantation
2.3 反向转矩值统计
3D打印氧化锆种植体组及CAD/CAM氧化锆种植体组的反向转矩值均大于35N•m;钛种植体组中2颗为20~35N•m,8颗大于35N•m。
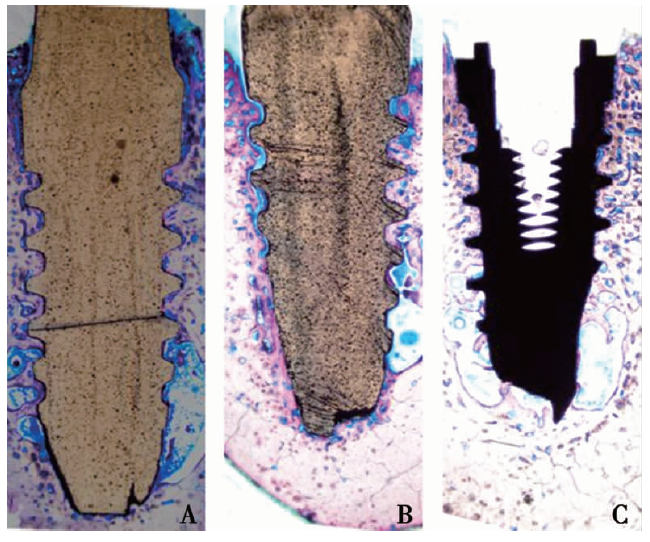
A:3D打印氧化锆种植体;B:CAD/CAM氧化锆种植体;C:纯钛种植体;密质骨、编织骨、类骨质、纤维软组织分别呈深紫色、浅紫色、蓝色、深蓝色;3D打印种植体、CAD/CAM氧化锆种植体、纯钛种植体分别呈黄棕色、黑色
图8 种植术后8周不脱钙种植体骨切片经亚甲基蓝酸性品红染色的光学显微镜图像
Fig.8 Optical microscope image of the undecalcified implants stained with methylene blue acid fuchsin at the 8th week after implantation
2.4 亚甲基蓝-酸性品红染色、骨接触率测定(图8)为种植体植入8周后,3D打印氧化锆种植体、CAD/CAM氧化锆种植体和纯钛种植体的亚甲基蓝酸性品红染色图。亚甲基蓝酸性品红染色可清晰显示新旧骨组织边界和成骨细胞,便于区分软硬组织。图中可看到紫红色的是骨小梁,蓝色的是间质。新生的编织骨较疏松,染色较深紫色;密质骨为浅紫色,骨小梁间的纤维网状结构为浅蓝色,纤维软组织呈深蓝色,蓝色为类骨质。另外,位于螺纹表面可以看到较粗的新生骨小梁。3组种植体不含骨髓腔骨结合率、含骨髓腔骨结合率、平均骨接触率和种植体周围骨密度数值如(表1)所示,差异均无显著性(P>0.05)。
03 讨 论
评价种植体骨结合性能的方法主要有影像学检查、旋出扭力法、硬组织切片技术等。本研究选择Beagle犬作为实验动物模型来评价种植体的骨结合性能,结合自身实验条件,选择X线牙片纵向观察种植体骨界面愈合情况、种植体旋出扭矩、种植体骨接触率、种植体周围骨密度等指标来比较3D打印氧化锆种植体、CAD/CAM氧化锆种植体、纯钛种植体的骨结合性能。
本实验采用X线片方法,观察种植体植入术后8周的骨界面愈合情况,结果显示3组标本均未发现种植体周围异常透射影像,植体植入的三维位置与相互距离均正确,表明实验动物模型成功建立。
旋出扭力法属破坏性实验,会使种植体的骨结合产生不可逆的损伤,所以临床应用受到限制。但其仍是动物实验中评价骨结合程度的重要方法,一般采用数字扭力测试仪测量并记录种植体骨结合被破坏时的扭力峰值,间接评价骨结合的状况。Sullivan 等[12]通过临床研究,将20N•m 的扭力阈值作为种植体骨结合成功的标准。本实验使用扭力扳手测量旋出扭矩峰值,结果显示种植体植入术后8周以后,3组种植体扭力峰值均大于20N•m,提示各组种植体均能形成良好的骨结合,可认为是成功骨结合的标准[13]。
不脱钙种植体骨切片技术因其可以保存骨组织的细微结构,已被广泛用于种植体骨结合的形态学研究。主要的骨形态计量学参数有骨接触率和种植体周围骨密度。骨接触率和种植体周围骨密度主要反映种植体周围新骨形成的量,这个量很难达到100%[14]。文献报道氧化锆种植体的BIC为27.1%~74.0%[15-16],纯钛种植体的BIC为23.2%~83.7%[17-18],一般认为大于50%为适宜的骨结合率[19]。并且所有研究均显示,同一观察时间点氧化锆种植体和钛种植体BIC差异无统计学意义。本研究植入8周时的组织学结果显示,3 组样本的平均骨接触率均达到48%以上,种植体周围骨密度均在58%以上,均可获得良好的初期稳定性,并且3组骨接触率和种植体周围骨密度的差异无显著性。基于本研究的结果可得出,3D打印氧化锆种植体、CAD/CAM氧化锆种植体和纯钛种植体可达到相似且良好的骨结合程度,此结果和Stenlund、王晓娜等的研究结果一致[20-21]。
技术服务咨询 步经理 18910422384
 官方微信
官方微信艾佧科技(北京)有限公司 地址:北京市经济技术开发区地盛南街1号1幢3041室
2020@ 艾佧科技(北京)有限公司 京ICP备10236589号