- 中国实验动物学报 第32卷 第2期 2024年2月
窦新雨1 , 2 , 3 , 刘宇1 , 2 , 3 , 刘啸1 , 2 , 3 , 祝斌4 , 贾斐5 , 王霖邦1 , 2 , 3 , 金攻6 , 沈飞7 ∗ , 刘晓光1 , 2 , 3 ∗
( 1. 北京大学第三医院骨科,北京 100191;2. 教育部骨与关节精准医学工程研究中心,北京 100191 ;3. 脊柱疾病研究北京市重点实验室,北京 100191;4. 首都医科大学附属北京友谊医院骨科, 北京 100050;5. 山东第一医科大学附属省立医院脊柱外科,济南 250000;6. 中奥汇成 科技股份有限公司,北京 100176;7. 北京大学第三医院实验动物中心,北京 100191)
目的 颈椎间盘突出症( cervical disc herniation , CDH) 是骨科常见疾病之一,随着对该疾病研究的深 入及颈椎内植物的发展,建立颈椎融合动物模型成为不可或缺的部分,目前国内对颈椎融合动物模型建立及评估 的研究报道较少,本研究以期为颈椎融合相关研究提供完备的动物模型和内植物性能的评估方案 。方法 选择小尾寒羊,改良术式后行颈椎前路椎间盘切除融合术( anterior cervical discectomy and fusion , ACDF) , 将聚醚醚酮 ( polyetheretherketone , PEEK) 椎间融合器( interbody fusion cage , Cage)(对照组)、3D 打印钛合金 Cage( 实验组 1) 及新方法钛合金 Cage(实验组 2) 分别植入每只羊的不同颈椎节段( C2/3 ~ C4/5) , 术后行血液学检测、组织病理学分析评估手术恢复情况及材料生物安全性,利用 X 光、CT、Micro⁃CT 及定量分析、硬组织切片染色、生物力学试验评估内植物的骨长入及骨融合情况 。结果 绵羊改良术式 ACDF 模型建立成功,血液学检测重要指标无显著性差异 ( P > 0. 05) , 组织病理学分析显示均无炎症细胞浸润等病理改变,内植物生物安全性良好,X 光及CT 显示内固定位置及椎间融合情况良好,术后3个月及6个月 Micro⁃CT 及定量分析表明,与 PEEK Cage 组相比,新方法钛合金Cage 组及 3D 打印钛合金 Cage 组内部的骨体积/总体积、骨小梁数目显著性升高( P < 0. 01) , 骨小梁间距显著性降 低( P < 0. 01) , 且新方法钛合金 Cage 组骨质长入更多( P < 0. 01) , 硬组织切片染色表明新方法钛合金 Cage 组及 3D 打印钛合金 Cage 组孔隙内有明显骨质长入且较为密实,结合较 PEEK Cage 组略好,生物力学试验显示,与 PEEK Cage组相比,新方法钛合金Cage及3D打印钛合金Cage在一定程度上降低了颈椎屈伸、侧弯、扭转运动范围 ( P < 0. 05) , 同时增强了颈椎的稳定性,且新方法钛合金 Cage更有优势( P < 0. 05) 。结论 建立绵羊改良术式 ACDF 模型后,利用合理有效的评估方法,证明了该模型的合理性及有效性,同时说明 3 种材料的 Cage 均显示出良好的生物安全性,新方法钛合金 Cage 及 3D 打印钛合金 Cage 较 PEEK Cage 的骨长入及骨融合性能更强,可增强颈椎的稳定性,且新方法钛合金 Cage 更有优势。
【关键词】 颈椎前路椎间盘切除融合术;颈椎间盘突出症;绵羊模型;椎间融合器
【 中图分类号】Q95-33 【 文献标志码】A 【 文章编号】1005⁃4847 (2024) 02⁃0139⁃ 12
颈椎间盘突出症( cervical disc herniation , CDH) 作为脊柱外科常见疾病之一,是指颈椎间盘髓核突破纤维环,向后方压迫脊髓或向后外侧压迫颈神经根而引起相应症状的疾病,以颈部酸胀疼痛、活动受限、上肢放射性疼痛麻木及下肢踩棉花感为主要症状[1] 。近年来,CDH 发病表现出年轻化趋势,严重影响了患者的工作及生活质量,给社会和经济带来严重的负担 。CDH 的治疗手段多样,保守治疗方案包括药物、针灸[2] 、理疗[3] 等,此外,介入治疗也在不断发展[4] 。当颈椎间盘突出较重,保守及介入治疗后反复或无效时,手术则成为重要的治疗手段 [5-6] , 根据颈椎间盘突出的数目及类型,目前临床常用手术方案包括颈椎前路椎间盘切除减压融合 术( anterior cervical discectomy and fusion , ACDF) 、颈椎后路单开门椎管扩大成形术、颈椎后路双开门椎管扩大成形术及微创手术等,其中,ACDF 手术较为 常见且有效[7] 。近年来,随着对 CDH 研究的深入及脊柱外科中颈椎内植物材料的发展,对相应颈椎融合动物模型的需求不断增大,建立理想且完备的动物模型及评价体系迫在眉睫 。小尾寒羊作为偶蹄目牛科羊属绵羊种动物,已被证明在颈椎解剖结构、生物力学、 骨密度及放射学特性上类似于人体颈椎,其中 C3/4 节段与人体颈椎最为相似[8] , 可作为理想的颈椎动物模型[9- 10] 。因此,本研究基于此,选择小尾寒羊作为实验动物,对手术方式进行革新,建立颈椎前路椎间盘切除融合模型,植入椎间融合器 ( interbody fusion cage , Cage) , 后续采取一系列检测方案,对手术安全性及植入物融合效果进行系统评估,以期为颈椎相关研究提供完善的动物模型方案。
18 只 24 月龄普通级雄性健康小尾寒羊,体重约 30 ~ 35 kg,购于北京富龙腾飞实验动物研究院有限公司【SCXK(京)2023-0009】,所有小尾寒羊采取自由饮水及定时普通牧草饲料喂养,昼夜各半循环照明,湿度适宜且恒定( 相对湿度为 50%) , 温度控制在 22 ~ 26℃ 。饲料由北京科澳协力饮料有限公司【SCXK(京)2020⁃0010】提供,手术及采食饲养2021-0054】进行 。饲养环境:普通级环境 。动物伦理通过北京大学第三医院伦理 委员会批准( A2022064) 。聚醚醚酮( polyetheretherketone , PEEK ) 颈椎Cage( 山东康盛,中国)、3D 打印钛合金Cage(爱康,中国)、新方法钛合金Cage(中奥汇成科技股份有限公司,中国)、颈前路螺钉及钛板系统 ( Stryker, 美国)、可吸收缝线( Ethicon , 美国)、4%多聚甲醛溶液 ( G1101 , 赛维尔,中国)、甲基丙烯酸甲酯光聚树脂 ( TECHNOVIT 7200 , EXAKT , 德 国)、糊状黏合剂 ( TECHNOVIT 4000 , EXAKT , 德 国)、精 密 粘 合 剂 ( TECHNOVIT 7210VLC , EXAKT , 德国)、塑料载玻 片 ( EXAKT , 德 国 )、甲苯胺蓝染色液试剂盒 ( G3663 , 索莱宝,中国)、亚甲基蓝染色液(G1303,索莱宝,中国)、酸性品红(F8220,索莱宝,中国)、Goldner三色染色液试剂盒( G3550,索莱宝,中国)、苏木精⁃伊红染色试剂盒( C0105S , 碧云天,中国)。
颈椎前路器械包( Stryker, 美国)、骨科手术器械包、C型臂X光机(联影,中国)、计算机断层扫描 ( computerized tomography, CT)机(联影,中国)、生物力学试验机( MTS 858 Mini Bionix Ⅱ , 美国)、光学测CT) 机( Siemens , 德国)、硬组织切片机( EXAKT , 德 国)、脱水浸透仪( EXAKT,德国)、光固化包埋仪( EXAKT , 德 国 )、NanoZoomer 全景扫描显微镜( Hamamatsu photonics , 日本)、光学显微镜( OlympusBH⁃2, 美国)。
18 只小尾寒羊采取随机数表法分组,每 3 只为 1 组,设置 6 组平行组,每平行组中每只羊植入 3 种 不同材料的椎间融合器 。随后,再以每节段颈椎为 观察分组单位,根据每节段颈椎植入的材料种类, 划分 PEEK Cage 为对照组,3D 打印钛合金 Cage 为 实验组 1 , 新方法钛合金 Cage 为实验组 2 , 平行组中 每只羊植入 Cage(见表 1) 。

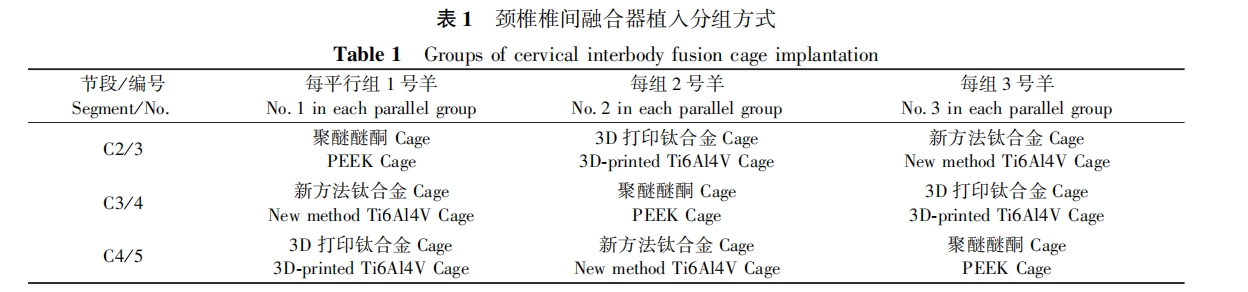
术前禁食24h , 不禁水,头皮针穿刺颈静脉并固定,5 mg/kg 丙泊酚推注,达到麻醉状态( 头颈及四肢瘫软,针刺无反应)后,行气管插管( 9. 5 ~ 10. 5 号气管插管),异氟烷吸入麻醉,潮气量10mL/kg ,呼吸次数每分钟 18 ~ 20 次,异 氟 烷 浓 度 2% ~2. 5%维持麻醉,静脉持续泵入美洛昔康注射液0. 05mg/( kg·h) 持续镇痛,选择仰卧位,将羊用绷带固定于手术台上,肩下垫枕,用C型臂 X 光机进 行透视定位 C2/3 , 常规消毒铺巾,行颈部中线右侧纵行长切口(切口长约12cm) , 逐层切开皮肤、皮下组织、颈阔肌,由颈血管鞘及内脏鞘之间入路,显露并纵行切开颈前筋膜,找寻颈长肌,于颈长肌两头间隙进入,显露3节椎体及椎间隙( C2 ~ C5 ) 。用咬骨钳去除椎体正前方突出的骨脊,钻孔拧入撑开固定钉,安放撑开器,撑开椎间隙,用小圆刀切开纤维环,利用颈椎刮匙、髓核钳等切除椎间盘,刮除椎体上下终板软骨,利用椎板钳将上、下椎体终板突出的弧形骨质去除,生理盐水冲洗,植入Cage ( 3D 打印 Cage 及新方法钛合金 Cage 不植骨,PEEK Cage 植入减压咬取的松质骨),松开撑开器使其嵌入椎间隙内,拔除撑开固定钉,用合适长度的颈前路 4 孔钛板及螺钉系统行内固定,上下椎体各拧入 2 颗螺 钉,行 X 光透视定位评估位置良好,彻底冲洗后,放置引流管一根,逐层缝合颈阔肌及皮下组织,关闭切口, 无菌敷料包扎伤口,观察术后活动及精神状态。
1. 2. 3 动物模型术后评估及取材
术后即刻行颈椎正侧位 X 光检查( 目标节段为 C2/3 ~ C4/5 ) , 术后 2 个月行颈椎 CT 检查、血常规、C反应蛋白及血清碱性磷酸酶水平检测,评估术后恢复情况 。术后 3 个月处死 3 组平行组取材,另 3 组于术后 6 个月处死取材,行相关标本检测,评估颈椎融合效果。
1. 2. 4 X 光检查
术后即刻及术后 2 个月行颈椎正侧位 X 光,评估手术内植物及内固定位置情况。
1. 2. 5 颈椎 CT 检查
术后 2 个月对羊模型行颈椎 CT 检查( 目标节 段为 C2/3 ~ C4/5) , 静脉注射戊巴比妥钠( 30 mg/ kg) 进行短期镇静,电流为200 mA , 电压为120 kV , 视场 21 cm , 切片厚度为 3 mm , 评估手术内植物位置及骨质生长情况。
1. 2. 6 血液学检测
术后 1 个月行血常规、C 反应蛋白检测,评估动物术后炎症情况,验证内植物的生物安全性,行血清碱性磷酸酶水平检测,评估动物成骨相关功能。
1. 2. 7 生物力学试验
处死羊模型后,将羊颈椎剔除所有肌肉组织,保留韧带、椎间盘,采用椎体整块切除术( en⁃block)获得每段功能脊柱单元标本后[11] , 螺钉穿过每个标本上下位椎体,包埋在聚甲基丙烯酸甲酯中,于生物力学试验机内固定,采用光学测量系统,在 2. 5 Nm 的纯力矩下,分别在屈伸、左右侧向弯曲和左右轴向旋转 3 个运动平面上进行柔韧性测试 。施加力矩的速率约为 0. 5 °/s , 重复 4 个完整的过程加载循环,其中前 3 个循环用于减少粘弹性效应,第 4 个循 环用于分析 。所有标本在室温下测试,测试出每个标本的运动范围( range of motion , ROM , ROM 定义为最小弯矩和最大弯矩期间的角位移),并比较其运动学行为。
1. 2. 8 Micro⁃CT 检查及定量分析
术后 3 个月处死 3 组羊模型取材,另 3 组于术后 6 个月处死,采用 en⁃block 方式对羊颈椎进行取材 。对颈椎标本进行 Micro⁃CT 扫描,扫描速度为6 °/min,分辨率为 9 μm。X射线源电压为80kV,束电流为80mA。使用多模态三维可视化软件 InveonResearchWorkplace对扫描结果进行重建和分析。通过划分不同的阈值单位(hounsfield,HU)来区分骨组织、软组织和钛合金Cage并进行后续定量分析。骨组织定义在 1000 ~ 2250HU范围内,金属定义为大于2250HU,软组织在0 ~ 1000HU。重建后选择植入物周围500μm区域和植入物内部孔隙空间作为感兴趣区域(region ofinterest,ROI)。在ROI中,骨体积/总体积(bone volume/total volume,BV/TV)、骨 表 面 积/骨 体 积( bonesurfacearea/bonevolume,BS/BV)、骨小梁数目 (trabecularnumber,Tb.N)、骨小梁厚度(trabecular thickness,Tb. Th)和骨小梁间距(trabecular spacing,Tb. Sp)通过InveonResearch Workplace直接计算得到,以此评估内植物骨长入及手术节段颈椎融合情况。
1. 2. 9 硬组织切片
将术后 3 个月及 6 个月处死羊模型获得的颈椎标本,用 4%多聚甲醛预固定1d。采用硬组织切片机修剪标本成适当形状,尽可能减小组织块的体积以便加快脱水浸塑的进程 。然后正式固定于 4%多聚甲醛中 2 周 。将固定后的标本用流水冲洗 15 min 后置于脱水浸透仪中,真空环境下于梯度乙醇中震荡脱水( 1000 mbar, 振荡频率每分钟 40 ~ 50 次), 分别为 40%乙醇 3 d、75%乙醇 3 d、95%乙醇 3 d、无 水乙醇 3 d。之后将标本块置于甲基丙烯酸甲酯 TECHNOVIT 7200 光聚树脂中浸塑 7 ~ 14 d。将完成脱水浸塑程序的标本放于包埋盒中,倒入光聚树脂,置于光固化包埋仪包埋,采用黄光照射5 h、蓝光 照射10 h固化 。包埋完成后将包埋好的标本块取出放在 60 ℃ 烘箱中 10 h 至彻底固化 。依照说明配制 TECHNOVIT 4000 糊状黏合剂,用黏合剂将标本粘于塑料载玻片上,用于制作硬组织切片 。先将标本用真空泵吸附在硬组织切片机上 。将标本沿植入体纵轴切开至显露出金属内植物,800#砂纸抛光、干燥 。然后用TECHNOVIT 7210VLC精密粘合剂将载玻片粘贴于标本上方,用金刚石锯切取厚度为 200 ~ 300 μm 的薄片,分别用 800#、1200#及 2000# 砂纸磨至 80 ~ 100 μm。重复上述操作,每个样本制备 5 张硬组织切片以供后续染色及组织学分析。此后,应用甲苯胺蓝染色液试剂盒、亚甲基蓝⁃酸性品红染色液以及 Goldner 三色染色液试剂盒染色, 使用 NanoZoomer 全景扫描显微镜和光学显微镜拍摄其整体和局部,观察 Cage 内骨长入及与周围椎体的成骨融合情况。
1. 2. 10 组织病理学分析
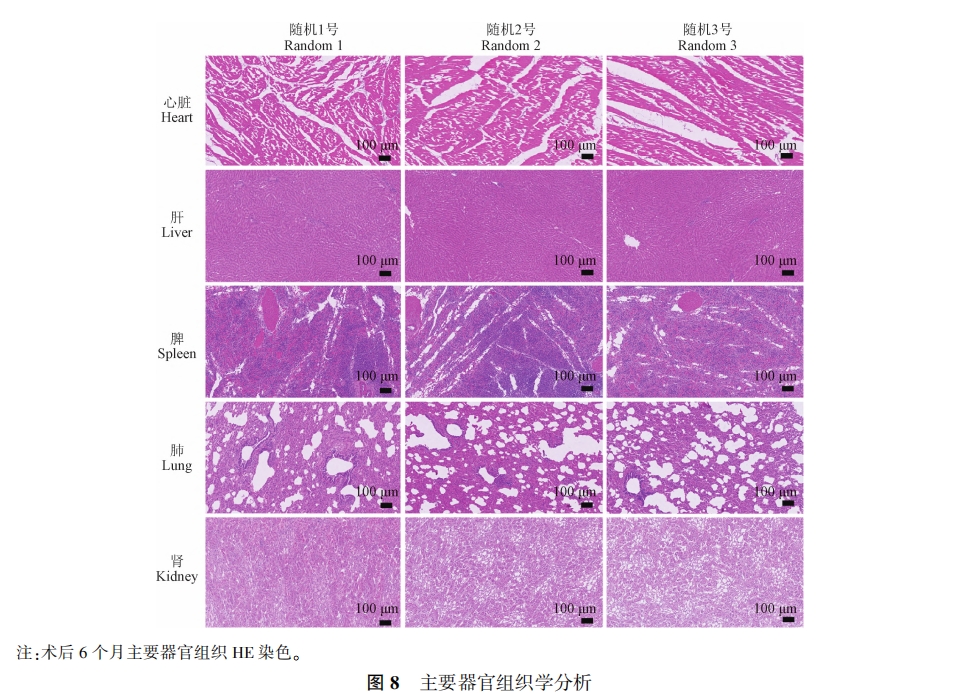
术后6个月处死羊模型后,随机抽取 3 只羊,选取心脏、肝、脾、肺、肾组织在 4% 的多聚甲醛中固定,将样品脱水后包埋于石蜡中行连续切片,采用苏木精⁃伊红( hematoxylin⁃eosin , HE) 染色,使用光学显微镜行镜检及图像采集,评估内植物对动物主要脏器的影响。
1. 3 统计学分析
计量资料用平均值 ± 标准差( x- ± s ) 的形式表 示 。所有数据均采用SPSS 22. 0 和 GraphPad Prism 8. 0. 2 软件进行统计学分析,两组以上的比较采用单因素方差分析( One⁃way variance , ANOVA) , 两组间比较采用独立样本 t 检验 。以 P < 0. 05 表示具有统计学意义。
2 结果
2. 1 手术效果及术后恢复情况
行术前准确定位后+ 图1A),所有建模手术均顺利进行,解剖及操作要点见图1B~1I,术后动物站立及四肢活动良好,精神状态可,除有1只羊术后存在异物排斥反应,致使伤口愈合缓慢外(后行数次伤口换药,伤口逐渐恢复),其余均无伤口渗液、感染等发生。所有模型自术后至处理期(喂养 3个月及 6个月)均无神经损伤表现,进食活动良好,体重正常增长。
2. 2 影像学检查结果 2. 2. 1 X 光检查
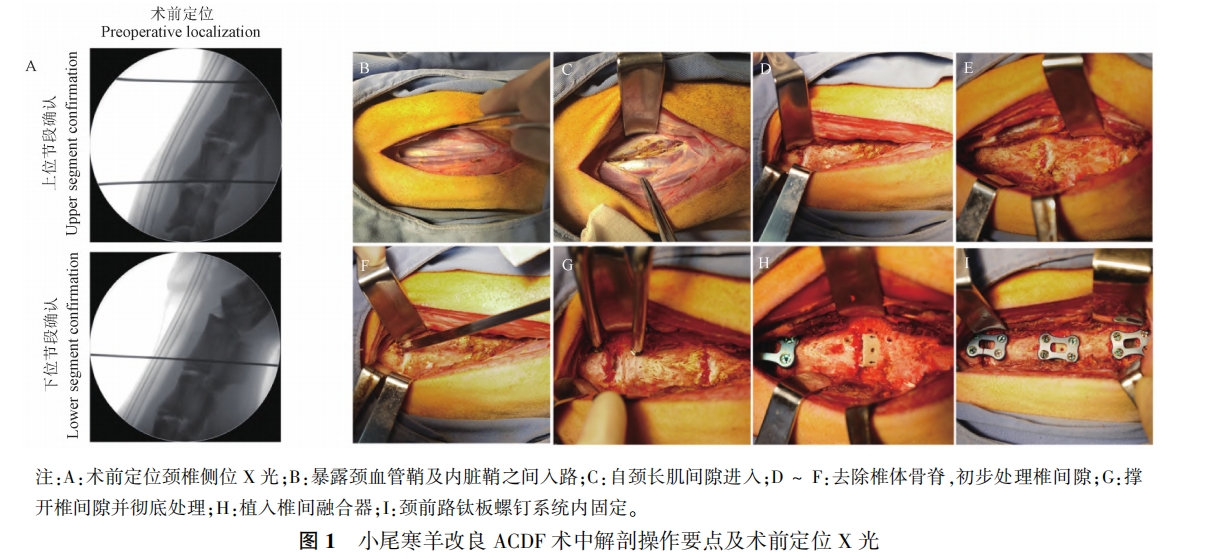
术后即刻行颈椎正侧位 X 光,观察到间盘处理充分,手术内植物及内固定位置良好,提示羊颈椎前路椎间盘切除融合模型建立成功( 图2A) 。
2. 2. 2 颈椎 CT 检查
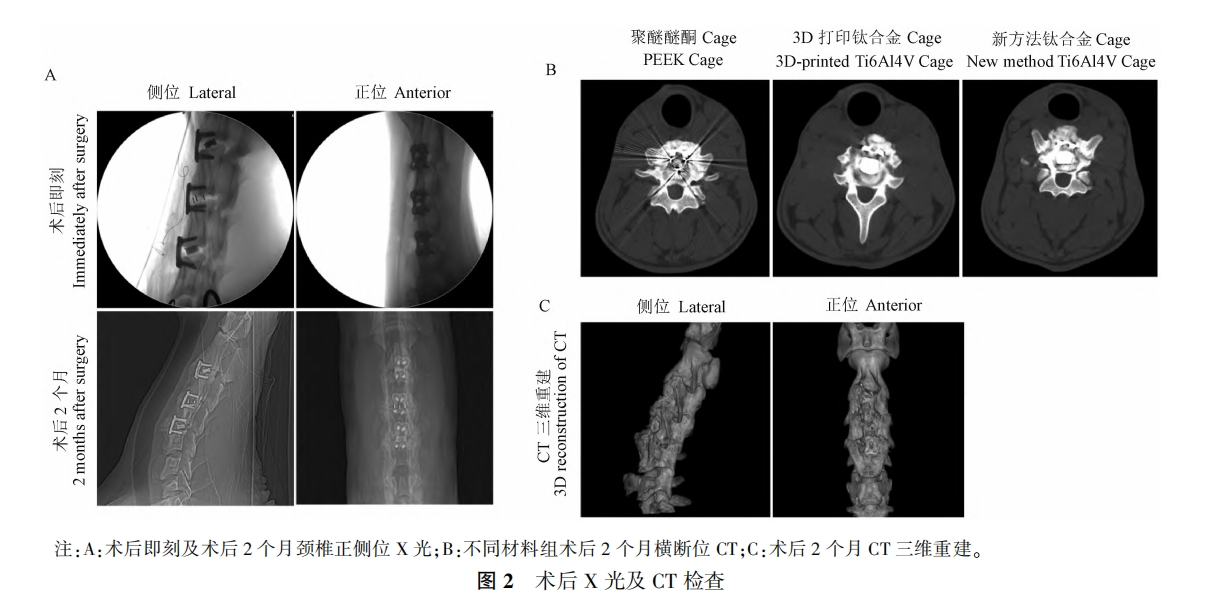
术后2个月行颈椎 CT,观察到羊模型手术节段颈椎间隙部分融合,不同材料Cage内均有骨质长入,内固定前方骨质增生(图 2B),在CT三维重建图像中该结果也得到了验证(图2C)。
2. 3 术后血液学检测
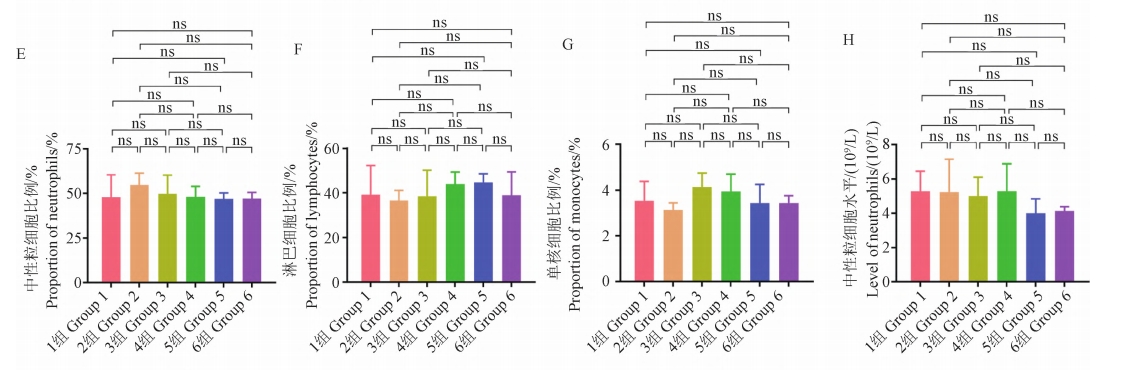
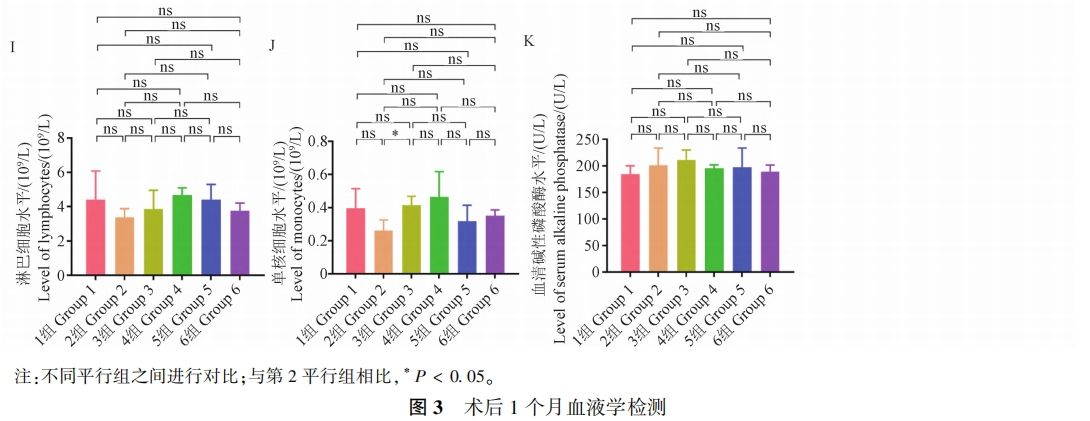
术后 1 个月行血液检测,结果显示各平行组血常规正常,重要指标组间无显著性差异(P > 0.05)(图 3A ~ 3J),C 反应蛋白结果表明未有感染发生(均< 5.0mg/L),各组血清碱性磷酸酶水平均高于正常值上限(100 U/L),提示成骨活跃(图 3K),上 述检测表明手术建立模型的成功以及内植物良好的生物安全性。
2. 4 生物力学试验
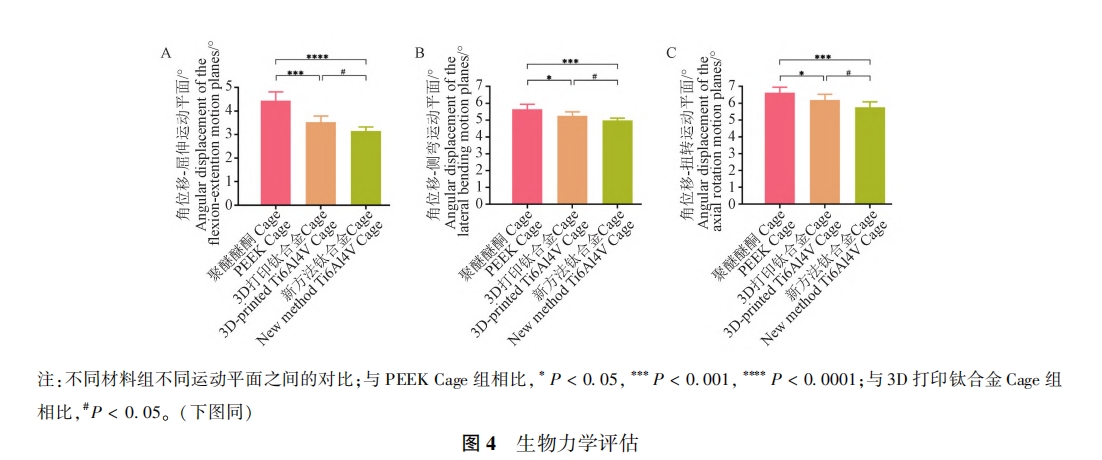
为了研究不同材料 Cage 对颈椎 ROM 和颈椎稳定性的影响,本研究对术后 6 个月颈椎样本进行了一系列生物力学试验 。结果如图 4 所示,对照组与实验组 1 及实验组 2 相比,在屈伸( 图 4A) 、侧弯( 图 4B)、扭转(图 4C)的关节活动度差异均有显著性(P < 0.05),表明了新方法钛合金 Cage及 3D 打印钛合金 Cage在一定程度上降低了颈椎的 ROM,同时增强了颈椎的稳定性,且新方法钛合金 Cage更有优势(P < 0.05)。
2. 5 Micro⁃CT 检查
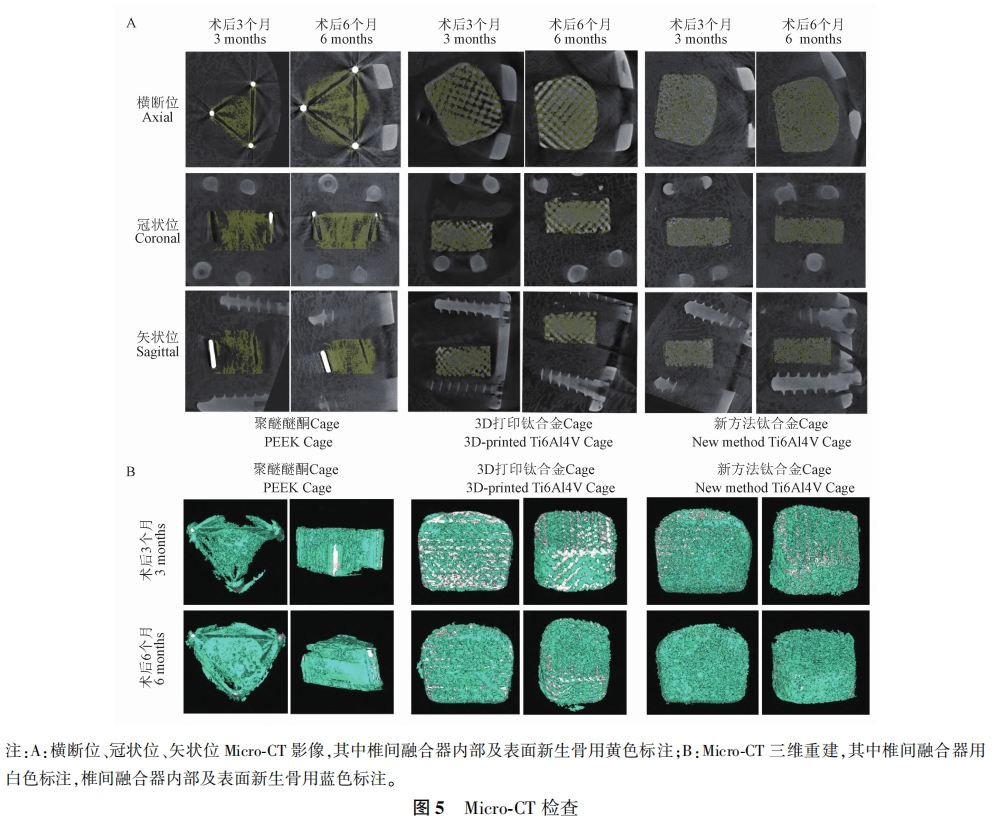
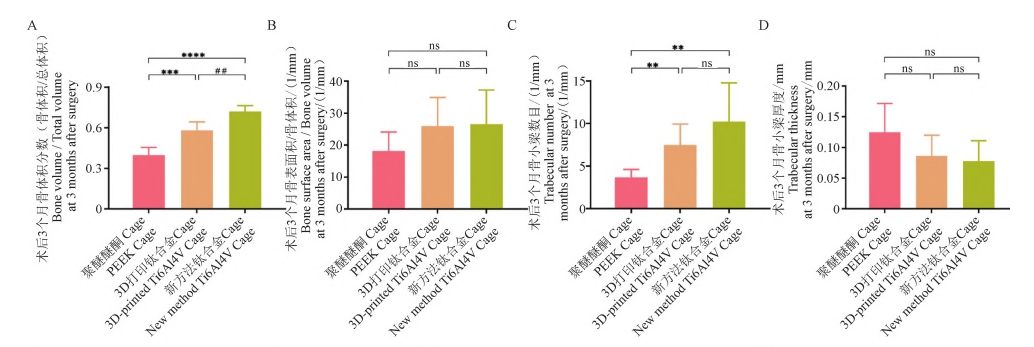
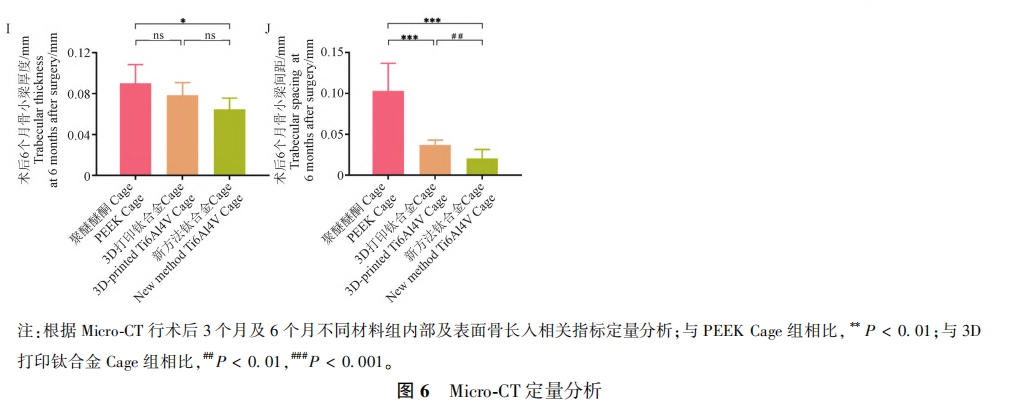
为了评估不同材料 Cage 的骨长入及骨融合性能,本研究通过Micro⁃CT,对术后3 个月及6 个月Cage内部及与椎体接触面的骨质进行了评估。如图 5A所示,在二维图像上,Cage内部及接触面的新生骨质被标记为黄色,相比于PEEKCage组,新方法钛合金 Cage组及 3D打印钛合金 Cage组在两个区域都有更多的骨形成。根据Micro⁃CT,不同材料组内部及表面骨长入相关指标(如 BV/TV、BS/BV、Tb.N、Tb.Th、Tb. Sp)的定量分析结果如图 6所示,结果表明,术后3个月及6个月,新方法钛合金Cage组及 3D 打印钛合金Cage组内部的BV/TV、 Tb.N显著性升高(P < 0.01),Tb. Sp显著性降低(P < 0.01),且新方法钛合金 Cage组骨质长入更多(P < 0.01),而在BS/BV、Tb.Th上无显著性差异(除术后6个月时新方法钛合金 Cage组在Tb.Th上 明显低 于PEEKCage组外,P>0.05)。此外,Micro⁃CT三维重建图像(Cage被标记为白色,内部及接触面的新生骨质被标记为蓝色)证实,新方法钛合金 Cage 组的骨长入及骨融合性能优于 3D 打印 钛合金 Cage 组及 PEEK Cage 组( 图 5B) , 这表明, 新方法钛合金 Cage 更能增强椎间骨长入及融合。
2. 6 硬组织切片及染色
对术后 6 个月不同材料 Cage 组标本行硬组织切片,随后使用甲苯胺蓝、亚甲基蓝酸性品红、Goldner 三色 3 种不同方式染色,结果如图 7 所示, 对于 PEEK Cage 组,因其内部有填入的自体骨质, 6 个月时 Cage 中心骨质连接完整,与上下终板融合为一体,但Cage表面与椎体界连接处有明显的空隙,提示骨界面结合较差。对于新方法钛合金 Cage 组及 3D打印钛合金 Cage组,术后6个月时 Cage 的孔隙内有明显骨质长入且较为密实,Cage表面与椎体骨界面虽也有空隙,但结合较PEEKCage组略好。

2. 7 组织病理学分析
对术后6个月随机抽取的羊模型心脏、肝、脾、 肺及肾组织行HE染色,由染色结果分析可得,各组间羊模型的重要器官组织形态正常,均无炎症细胞浸润等病理改变( 图 8) , 证明了材料具有良好的生物安全性。
3 讨论
目前,骨科新材料研究如火如荼,尤其在脊柱外科内植物方面取得了重要突破(如人工椎体[12] 、人工椎间盘[13] 、椎间融合器[14] 、脊柱内固定系统 [15- 16] 等),其中,颈椎内植物相关研究的飞速进步对颈椎融合动物模型的建立提出了更高的要求。 通过建立颈椎融合动物模型,可验证颈椎内固定器材的生物相容性及稳定性,亦可评估内植物材料或 生物制剂对于骨融合的效果 。因绵羊颈椎在解剖结构、前凸程度、材料性质及生物力学上与人体颈椎具有较高的相似性,其模型在国内外颈椎研究中已被广泛应用,成为了此类研究中必不可少的研究 工具及手段[17- 19] 。此外,由于绵羊颈椎间盘具有高度较大的特点,也使其颈椎融合模型成为评估颈椎内植物的理想模型[20] 。然而,国内对于绵羊颈椎融合模型的建立及评估方法的研究较少,本研究通过改良手术方案建立小尾寒羊 ACDF 优化模型,植入3种不同材料的 Cage , 而后制定较为完备的评估方法以评价不同 Cage 的骨长入及骨融合性能,以期为后续研究者提供思路。本研究选取 ACDF 手术方式建立小尾寒羊颈椎融合模型,与常规 ACDF颈椎融合动物模型建立时采用颈部横行切口不同的是,本研究采取改良术式,对模型手术方式进行优化,在符合动物伦理的要求下,采用颈部纵行切口,以缩减颈部切口数量,此外,纵行切口也便于选择合适的手术入路,以减少手术过程中对羊的损伤。该优化术式在多节段颈椎间盘的处理中具有优势,可充分利用羊颈椎节段,具有一定的经济实用性及有效性。行手术解剖入路时发现,绵羊的颈阔肌只有薄薄一层,切开时要特别注意不要损伤深部组织,电凝止血后由颈血管鞘及内脏鞘入路,剥开颈前筋膜,发现颈长肌一般为分叉状,从肌肉分叉处进入,可减少对于肌肉的损伤以及出血,认为这是很重要的。减压融合可按常规手术进行,值得注意的是,因绵羊的下位椎体前端终板有弧形凸起,且绵羊椎体后缘较前缘略高,应当用椎板钳将间隙仔细处理成平台状,才可便于置入椎间融合器。术后切记密切观察绵羊苏醒后四肢活动情况、进食及精神状态,以确保术中无神经损伤的发生。值得注意的是,在术后恢复期,因进食及生活习性,绵羊无法像人类行颈托制动控制颈椎大幅度的活动,但本研究发现该问题并未影响术后内固定的稳定度及并发症的发生,反而因其术后早期开始颈部活动,颈部活动度恢复更佳。此外,在观察期内,未发现内固定松动及神经损伤的表现,日常活动及进食正常。对于实验分组方案,本研究将 3种不同材料 Cage分别植入每只羊的不同颈椎节段,这可以消除因个体差异产生的误差。但由于不同颈椎节段生物力学性能、椎间隙高度、所承受的应力等存在差异,因此本实验将同一材料 Cage植入每平行组中羊的不同颈椎节段,确保每组羊中同一颈椎节段均有同种材料 Cage植入,通过设立多组平行组的方法,使实验设计符合统计学要求。对于模型评估方案,本研究选择血液学检测、组织病理学分析、影像学检查、Micro⁃CT 检查及分析、硬组织切片染色分析、生物力学试验等手段,充分涵盖了对于材料的生物安全性、骨长入及骨融合性能以及颈椎生物力学方面的评估。血液学检测反映出动物体内有无贫血、炎症反应发生及成骨活跃情况,重要器官组织病理学分析展现了内植物对于各器官有无病理损害,上述检测方案可证明内植物的生物安全性[21-22] 。影像学检查中,X光可以评估术后内固定位置及神经减压情况,活体颈椎CT检查反映出术后 2个月颈椎间隙高度及融合情况,需要注意的是,CT显示椎间隙前方内固定被骨组织包裹,手术节段椎体被骨桥连接一体,这反映了绵羊极强的成骨功能,在颈椎屈伸活动时有极高的稳定性,这一点也在取材时大体标本上得到证明。Micro⁃CT 检查及分析可以更直观地反映术后 3 个月及6个月标本中内植物中骨长入及与椎间隙融合情况,并能通过计算相关指标来量化这些改变,使得评估更为细致,更具可信度[23] 。此外,选取硬组织切片染色及软件定量分析方案,能更有对比性且更为客观地反映出内植物内新骨生成情况,使结果更具说服力[24] 。作为评估脊柱活动度及稳定性的重要方法,生物力学试验重要性不言而喻[25] , 本研究通过生物力学试验机,测定颈椎屈伸、侧弯及轴向旋转的运动范围,可用于评价不同内植物的骨融合及脊柱稳定性。根据本研究结果,3 种材料均展现出了良好的生物安全性;在骨长入及骨融合性能方面,新方法钛合金 Cage及 3D打印钛合金 Cage更有优势,且新方法钛合金 Cage性能更佳;在生物力学方面,新方法钛合金 Cage及 3D打印钛合金Cage在一定程度上降低了颈椎的ROM,同时增强了颈椎的稳定性,且新方法钛合金Cage更有优势。上述结果证明了两实验组材料可以有效地维持椎间隙高度,促进骨长入及椎间融合,术后无明显炎症反应及并发症发生,表明材料在动物体内具备良好的安全性以及有效性。因此,本研究在成功建立小尾寒羊颈椎ACDF优化模型的同时,也为材料的临床应用奠定了前期动物实验基础。













 官方微信
官方微信