目的 探究骨膜下植骨( Sub-periosteal Peri-implant Augmented Layer,SPAL) 技术对于修复种植体颊侧骨缺损的组织学可靠性。方法 选取20只日本大耳白兔,应用随机数表法将其分为引导骨再生( Guided bone regeneration,GBR) 组(A组) 和SPAL组(B组) 两组,每组各10只。拔除兔下颌切齿同期植入种植体建立骨缺损模型。骨增量 A 组采用 GBR技术,B组采用 SPAL 技术。术后即刻、1个月、3个月、6个月取材进行 Micro CT 扫描及组织学观察。结果 实验操作可实现理想骨充填,术后 1个月时,B组种植体颊侧多个水平层面骨壁厚度及整体骨体积均明显高于A组。术后 3个月时,B组种植体颊侧骨量高于A组,差异具有统计学意义( P<0.05) 。术后6个月时,两组种植体颊侧最终骨量趋于等量。组织学观察可知,两组种植体颊侧均可实现成熟板层骨结构。结论 SPAL 骨增量术后无纤维组织长入成骨区,术后6个月可实现种植体骨结合及颊侧骨再生,效果与传统 GBR技术无显著差异。且骨膜替代人工屏障膜有利于维持原始骨壁,具有更好的空间维持作用。
【关键词】 骨膜;屏障膜;骨再生;种植体
[中图分类号]R78 [文献标识码]ADOI: 10.3969 /j.issn.1002-1256.2024.21.003
在临床中,牙齿缺失后牙槽嵴颊侧发生不同程度的水平向骨缺损的情况是非常常见的。这是由于随着牙槽窝愈合过程中的骨改建和重塑[1],剩余牙槽嵴会发生一定程度的萎缩。其中,垂直向骨吸收通常为2~4 mm,且当邻牙存在时吸收量更少,而水平向骨吸收可达 5~7 mm,相当于原牙槽嵴宽度的一半[2-3]。其中,颊侧骨板吸收量又要远远多于舌侧。
种植修复的目的在于恢复口腔功能及美学效果; 保证远期的稳定; 减少并发症风险。其中,保证远期稳定性的关键在于要确保种植体全部位于健康的牙槽骨内,且骨壁厚度至少 1.5 mm[4-6]。当种植体颊侧骨壁存在裂开型骨缺损时,发生种植体周围炎的风险会大大提高[7-8],且软组织并发症增多。当种植体颊侧骨壁完整但厚度<1.5 mm 时,术后2个月该位点会发生约3mm 的垂直向骨吸收; 而当颊侧骨壁
厚度>1.5 mm 时,远期骨量基本保持稳定[9]。综上所述,无论是种植体颊侧存在骨缺损还是颊侧骨壁完整但厚度<1.5 mm,都必须进行骨增量手术恢复颊侧骨壁厚度。
GBR技术是目前口腔种植临床中最常用的骨增量术式[10]。GBR的原理就是通过屏障膜的应用阻止缺损区内增殖较快的上皮细胞和成纤维细胞长入,从而保证增殖速度较慢的成骨细胞和血管能够优先长入屏障膜下方血凝块占据的间隙内[11]。但由于 GBR术中的骨膜减张切口破坏了骨膜结构的完整性,损伤了骨膜生发层,使得骨膜的成骨潜能在 GBR术式未能得到充分利用。
SPAL是一种种植同期修复颊侧骨缺损的新型术式[12]。通过对颊侧瓣进行半厚分离,外层黏膜瓣可达到无张力的冠向复位,实现伤口的严密关闭。内层完整的骨膜瓣不仅降低了手术创伤,同时为骨膜成骨潜能的发挥奠定了解剖学基础。由于避免了人工屏障膜的使用,手术成本大大降低。在Trombelli 的临床研究中确实报道了理想的成骨效果。但目前SPAL 技术缺乏对种植体周骨水平的长期追踪,成骨质量以及骨再生过程中是否有纤维组织长入不得而知。本研究欲通过动物实验,探究 SPAL 技术对于修复种植体颊侧骨缺损的组织学可靠性。
1.实验动物: 选取20只日本大耳白兔,雄性,1~2 岁龄,平均体重 2.5~3.0kg,口腔内无疾患。应用随机数字表法将其分为 GBR 组( A 组) 和 SPAL 组( B 组) 两组,每组各10只,每只兔下颌可提供2个实验位点。
2.设备和材料: (1) 钛合金种植体3.5mm×8mm及配套覆盖螺丝; (2) 骨增量材料 Gesitlich Bio-Oss,Gesitlich Bio-Gide; (3) 常规手术器械; (4) 打磨机;(5) 小动物显微 CT( Micro CT,Bruker Skyscan1276) ;(6) EXAKT 300PC 硬组织切片机( 德国 EXAKT公司) ; (7) EXAKT 400 磨片机( 德国 EXAKT 公司) ;(8) 研磨砂纸( 320、800、1200、4000目,德国) ; (9) 生物显微镜( 奥林巴斯 BX53) 。
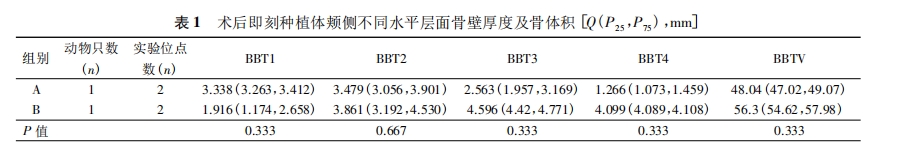
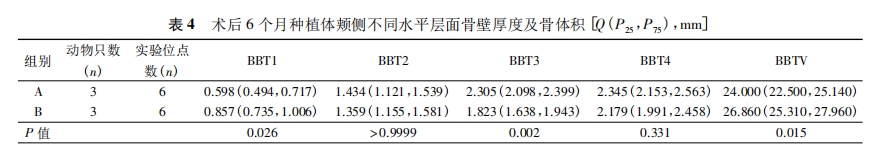
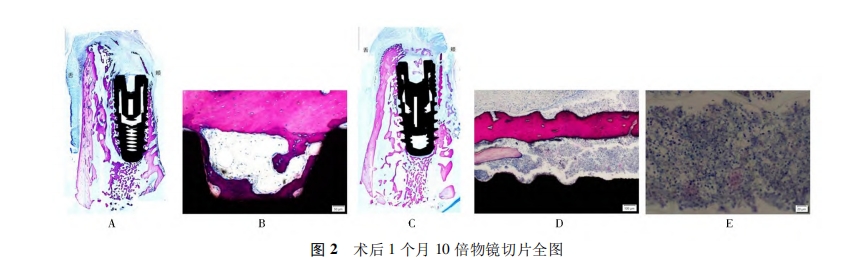
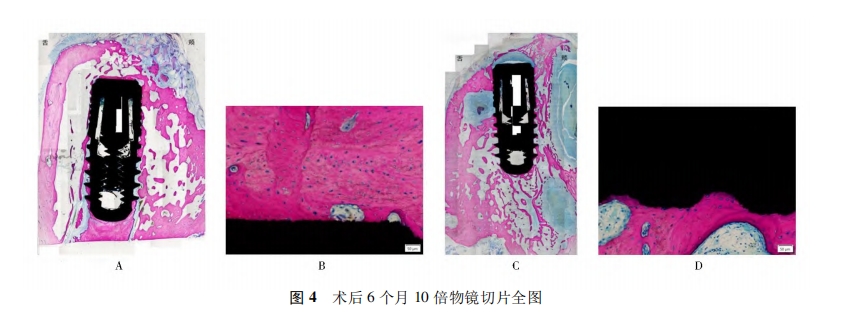
3.研究方法: (1) 手术方式: ①术前准备: 实验前3天确认实验动物身体精神状况良好,可以承受外科手术操作。对实验动物进行称重,按照300mg /kg 应用全麻药物。肌内注射全麻药物盐酸赛拉嗪注射液后,等待3~5min,若动物仍与麻醉前活跃程度相似,则再次给予异氟烷吸入性麻醉药物,增强麻醉效果2~3min 后,可见动物活跃度明显降低。使用棉絮轻轻触及动物眼睑缘,检查动物眼睑反射消失,同时观察到瞳孔缩小,拉动动物四肢无肌张力后,表明实验动物已进入手术麻醉状态。将实验动物仰卧,四肢用绷带缠绕固定于兔台上,使用棉签蘸取碘伏消毒液充分擦拭动物口腔内部及上下唇,铺无菌孔巾。②翻瓣及微创拔牙: 于实验动物下颌两颗切齿的颊侧龈颊沟处再次局部注射阿替卡因肾上腺素注射液行浸润麻醉,1~2min 后,使用15c刀片做下颌切齿的龈沟内切口,切断下颌正中系带与牙面的附着。刀片尽量与牙体长轴平行,避免损伤骨膜组织。再在两颗切齿远中做水平附加切口,长度约2mm,如图 1A。小心剥离颊侧黏膜直至暴露颊侧牙槽嵴,保证骨膜组织完整,如图1B。适当剥离舌侧黏膜,同样注意保证骨膜完整。翻瓣完成后,开始微创拔牙。使用刃薄的骨膜分离器置于两颗切齿之间的牙槽间隔处,近远中向施力挺松牙齿,如图 1C。止血钳加持牙齿后小幅度颊舌向、近远中向晃动,并向上、向内旋转施力拔出切齿,如图1D。此时可见拔牙窝舌侧骨壁高耸,颊侧骨壁的高度低于舌侧约3~5mm。颊侧骨壁表面存在天然滋养孔结构,孔内可见红色血液。使用咬骨钳少量去除舌侧高耸骨壁,使颊舌侧骨壁的高度差约为2mm,如图1E。注射器抽取氯化钠注射液后冲洗拔牙窝并使用无菌纱布擦干。③植入种植体及骨增量: 于拔牙窝内手动旋入实验用种植体,至种植体平台水平高于颊侧牙槽嵴顶约2mm,即种植体颊侧冠方2mm 处暴露在骨壁之外,舌侧完全位于骨壁内,如图1F~H。实验组的骨增量操作:首先,使用两把镊子分别加持颊侧黏骨膜瓣的近远中冠方边缘,稍微用力提起黏骨膜瓣可形成口袋状。将 Bio-Oss 小颗粒骨移植材料用氯化钠注射液浸湿后覆盖于种植体颊侧,并严密充满颊侧黏骨膜瓣所形成的口袋,如图 1I。再将颊侧黏骨膜瓣与舌侧瓣拉拢对位缝合。对照组的骨增量操作为: 先根据两颗切齿颊侧骨壁的尺寸和形状修剪 Bio-Gide 可吸收生物胶原膜,保证长度足够覆盖牙槽嵴顶及舌侧。使用15c刀片轻轻划断颊侧黏骨膜瓣偏根方的骨膜组织,避免割断全层组织,此时可见少量出血,如图1J。将修剪合适的生物胶原膜插入口袋状的黏骨膜瓣内侧,血液浸透胶原膜根方,使其与黏骨膜瓣的根方贴合,冠方仍保持干燥直立,如图1K。同样Bio-Oss小颗粒骨移植材料用氯化钠注射液浸湿后覆盖于种植体颊侧,并严密充满颊侧黏骨膜瓣所形成的口袋,如图 1L。此时将生物胶原膜向舌侧反折,完全覆盖牙槽嵴顶后插入到舌侧黏骨膜瓣内,再使用氯化钠注射液润湿,使之贴合,如图 1M。将颊侧黏骨膜瓣与舌侧瓣拉拢对位缝合,如图 1N。④术后取材: 术后连续3d肌内注射抗生素,预防术后感染。进行正常喂养,创口缝线不拆除,任其自行脱落。术后即刻 A、B组各处死一只兔进行下颌前部取材,术后 1个月、3个月、6个月 A、B 组各处死三只取材。(2) Micro CT 扫描测量: 标本进行 Micro CT 扫描,使用CTAn分析软件测 量: ①种植体颊侧骨壁厚度(Buccal bone thickness,BBT) ,分别选取种植体顶端水平(BBT1) 、顶端根方2mm(BBT2) 、顶端根方4mm(BBT3) 及顶端根方6mm(BBT4) 水平测量种植体颊侧骨壁厚度; ②种植体颊侧骨壁体积(buccal bone volume,BBV) 。(3) 组织学观察: 标本经脱水包埋后,沿颊舌向纵向切割为200μm切片,依次研磨至20~30μm,然后进行 Leva-Laczko 染色过程,形成最终切片,进行观察。
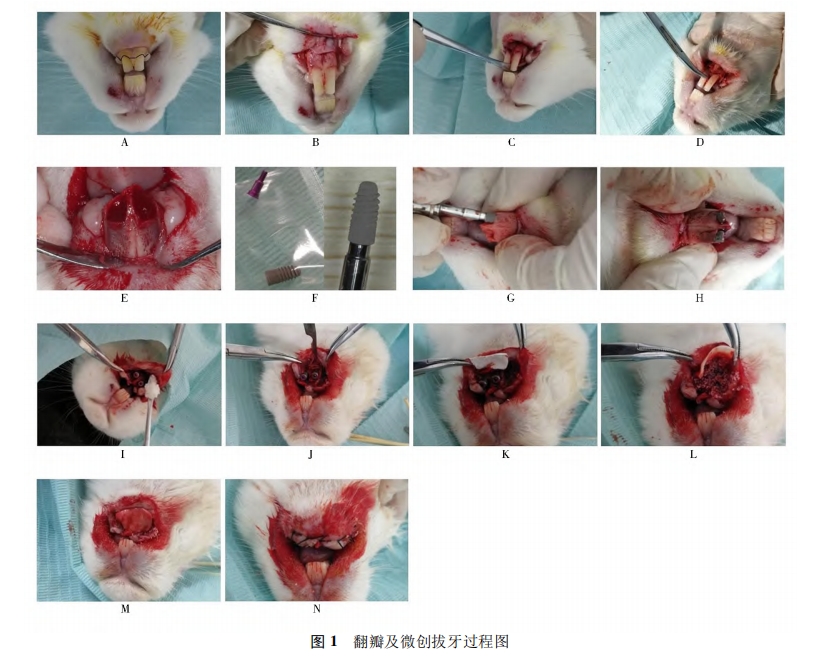
所有实验动物术后一般状况良好,无死亡,口腔内创口无感染、裂开,无种植体、颗粒状骨移植材料、生物胶原膜暴露。



技术服务咨询 步经理 18910422384
 官方微信
官方微信艾佧科技(北京)有限公司 地址:北京市经济技术开发区地盛南街1号1幢3041室
2020@ 艾佧科技(北京)有限公司 京ICP备10236589号